Stollingscorrectie op basis van trombo-elastografie/-metrie in vergelijking met standaard laboratoriumtests
Uitgangsvraag
Wat is het effect van stollingscorrectie op geleide van coagulopathie gemeten met tromboelastografie (TEG) of tromboelastometrie (ROTEM) in vergelijking met stollingscorrectie op geleide van coagulopathie gemeten met standaard laboratoriumtesten bij volwassenen met een verbloedingsshock of risico op stollingsstoornissen door een acute bloeding bij electieve ingrepen?
Aanbeveling
Maak gebruik van behandelalgoritmen op basis van TEG of ROTEM, als onderdeel van het behandelprotocol bij een acute bloeding ten gevolge van cardiothoracale chirurgie.
Overweeg gebruik van behandelalgoritmen op basis van TEG of ROTEM als onderdeel van het behandelprotocol bij een acute bloeding ten gevolge van brandwondenchirurgie, leverchirurgie en trauma.
Hanteer bij patiënten met postpartumbloedingen het lokale behandelprotocol, gezien er vooralsnog onvoldoende gegevens beschikbaar zijn om een conclusie te trekken over de effectiviteit van TEG of ROTEM bij postpartumbloedingen.
Behandel patiënten met een dreigende verbloedingsshock volgens het massaal transfusieprotocol. Neem lab af en zet (indien beschikbaar) TEG of ROTEM in. Stel beleid bij op geleide van stollingsparameters en/of TEG of ROTEM.
Overwegingen
Algemeen
Stollingscorrectie bij coagulopathie ten gevolge van massaal bloedverlies, gemeten met TEG/ ROTEM of met een combinatie van klinische besluitvorming en standaard laboratoriumtesten werd veelvuldig onderzocht maar de bewijskracht voor de meeste uitkomstmaten is laag of zeer laag. De 13 geïncludeerde RCT’s hebben relatief lage patiënten aantallen. De studies betroffen voornamelijk cardio chirurgische ingrepen, RCT’s bij postpartum bloedingen ontbreken. De resultaten van een grote, ten tijde van deze module-ontwikkeling, lopende RCT studie (n=392) naar de TEG/ROTEM in vergelijking met standaard laboratoriumtesten in traumapatiënten (iTACTIC), kunnen na publicatie meer inzicht geven in deze behandelmethoden bij traumapatiënten (Baksaas-Aasen, 2017). Een deel van de geïncludeerde studies (4/13) hadden naast TEG of ROTEM ook andere laboratoriumtesten toegevoegd aan het behandelalgoritme. Deze studies werden geëxcludeerd in een sensitiviteitsanalyses, maar de resultaten waren vergelijkbaar.
Diagnostische hulpmiddelen ter monitoring en behandeling van bloedingen (standaard laboratoriumtesten of TEG/ROTEM) hebben zelf geen effect op de klinische eindpunten; het effect van de laboratoriumtesten wordt veroorzaakt door het bijpassende protocol/algoritme. Behandelalgoritmes gebaseerd op standaard laboratoriumtesten zijn vrijwel altijd anders samengesteld dan algoritmes op basis van TEG/ROTEM én bevatten andere (combinaties van) bloedproducten. De verschillende behandelalgoritmes zijn niet onderzocht in deze richtlijn. Tevens bevatten behandelprotocollen gebaseerd op standaard laboratoriumtesten minder vaak geïsoleerde stollingsfactoren zoals fibrinogeen concentraat, protrombine complex en tranexaminezuur. De algoritmes achter de diagnostische testen werden niet nader beschreven of onderzocht in deze analyse en waren geen onderdeel van de vraagstelling. Het grote verschil tussen standaardtesten en TEG/ROTEM is dat de testresultaten van TEG/ROTEM sneller beschikbaar zijn en deels andere informatie over de hemostase leveren.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De interventie TEG/ROTEM heeft een gering effect op mortaliteit en chirurgische re-interventies met een lage gradering van het bewijs. Het kleine effect op mortaliteit wordt gezien in alle drie de patiëntengroepen (cardiochirurgie, lever chirurgie en trauma). Het geringe effect op chirurgische re-interventies werd alleen onderzocht in de zeven cardio chirurgische studies. De interventie heeft geen effecten op het aantal patiënten dat de diverse bloedproducten (erytrocyten, plasma’s, trombocyten) ontvangt en op het cumulatieve bloedverbruik van rode bloedcel, trombocyten en plasma eenheden na 24 uur en opnameduur. Conclusies over het effect van de interventie op het verbruik van geïsoleerde stollingsfactoren (fibrinogeen, PCC en factor VIIa) zijn niet mogelijk omdat deze eindpunten vrijwel niet (n=3) werden gerapporteerd. Het verbruik van tranexaminezuur werd niet gerapporteerd in de studies en hierdoor niet onderzocht in deze module.
De discrepantie tussen het geringe effect op mortaliteit en het uitblijvende effect op bloedverbruik kunnen we met de bestaande eindpunten niet verklaren. Een mogelijke oorzaak kan zijn, dat door de snellere beschikbaarheid van TEG/ROTEM uitslagen, minder ondertransfusie en overtransfusie, andere peri- en post operatieve interventies (of het uitblijven van deze interventies) dan het transfunderen van kort houdbare bloedproducten hebben geleid tot een effect op mortaliteit (vulling van de patiënt, medicatie, andere stollingsfactoren (fibrinogeen, tranexaminezuur, protrombinecomplex)).
Er zijn geen uitkomstmaten beschikbaar over de snelheid waarmee de uitslagen van de interventie testen versus de traditionele testen beschikbaar waren. Deze zogenaamde turnaround tijd (TAT), kan het verschil maken in de mate waarop het behandelalgoritme kan worden gevolgd. In het algemeen kan worden gesteld dat behandelalgoritmen in spoed situaties waarin laboratoriumuitslagen worden gebruikt ten behoeve van therapeutische besluitvorming beter kunnen worden opgevolgd indien de uitslag tijdig beschikbaar is. Het effect van de interventie waarbij uitslagen sneller bekend zijn (volbloed, point of care test) kan hierdoor meerwaarde hebben en leiden tot andere besluitvorming in behandeling dan alleen het wel of niet toedienen van de kort houdbare bloedproducten.
Kosten (middelenbeslag)
De interventie vergt een uitbreiding van hardware, procedures, training en brengt hierdoor extra eenmalige kosten met zich mee. De standaard laboratoriumtesten (aPTT, PT, fibrinogeen bepaling) komen niet te vervallen voor het betreffende laboratorium/ziekenhuis omdat ze complementair zijn/blijven voor andere indicaties.
De integrale kostprijs van de interventie testen is hoger dan de prijs van de standaard testen. Afhankelijk van de grootte van het ziekenhuis en aantal patiënten zal het niet mogelijk zijn op alle relevante plaatsen in het ziekenhuis te beschikken over de Point of care testen (POCT) toepassing en zal er een centrale plaats voor deze analysemethode moeten volgen. Dit kan ten koste gaan van de snelheid tenzij er goede logistieke afspraken (transport van monsters per buizenpost) worden gemaakt. Het centraal plaatsen van laboratoriumapparaat kan de betrouwbaarheid en kwaliteit(controles) van de uitslagen bevorderen. De nieuwe ontwikkelingen in visco-elastische testen volgen elkaar snel op en op dit moment is de uitvoering van de nieuwere testmethodes nog sneller, veiliger en makkelijker geworden dan de methoden in de beschreven RCT’s. De interventie vergt minder bloedafnames bij de patiënt mits het hematocriet voldoende is dat ook POCT gemeten kan worden (van 2 naar 1 buis bloed).
Aanvaardbaarheid, haalbaarheid en implementatie
Op dit moment (2019) is TEG/ROTEM beschikbaar in 38 % van de Nederlandse ziekenhuizen. De interventie vergt een goede samenwerking tussen laboratorium en kliniek rondom de aanschaf, implementatie van algoritmes, kwaliteitsborging, structurele training en bijscholing (technisch en vakinhoudelijk) van alle professionals die betrokken zijn bij de behandeling van de bloedende patiënt. Deze ketenverantwoordelijkheid kan de bewustwording en continue verbetering van behandelalgoritmen voor massale bloedingen vergroten.
Rationale van de aanbeveling
Stollingscorrectie op basis van TEG/ROTEM lijkt geen duidelijk effect te hebben op bloedverbruik (zowel aantal personen als hoeveelheid bloedverbruik), het resulteert mogelijk wel in een lagere mortaliteit en minder chirurgische re-interventies. De kostprijs voor TEG/ROTEM is hoger dan standaard laboratoriumtesten, maar de snelle beschikbaarheid van de resultaten zou mogelijk kunnen resulteren in een betere behandeling.
Onderbouwing
Achtergrond
Stollingscorrectie bij coagulopathie veroorzaakt door (massaal) bloedverlies wordt op dit moment uitgevoerd op geleide van klinische besluitvorming met standaard laboratoriumtesten (aPTT, PT, fibrinogeen) en/of op geleide van TEG of ROTEM. De laatste testen hebben een ander detectiemechanisme van het bloedstolsel dan de traditionele testen en worden uitgevoerd in volbloed in plaats van plasma. Het is nog onduidelijk welke van beide testprincipes een betere methode is voor de begeleiding van stollingscorrectie bij (massale) bloedingen.
Conclusies
|
Laag GRADE |
Mortaliteit Stollingscorrectie op geleide van TEG/ROTEM vergeleken met standaard laboratoriumtesten leidt waarschijnlijk tot een lagere mortaliteit.
Bronnen: ( Ak, 2009; Girdauskas, 2010; Gonzalez, 2016; Paniagua 2011, Royston, 2001; Shore-Lesserson, 1999; Wang, 2010; Weber, 2012) |
|
Zeer laag GRADE |
Aantal patiënten dat erytrocyten ontvangt Stollingscorrectie op geleide van TEG/ROTEM vergeleken met standaard laboratoriumtesten heeft wellicht geen effect op het aantal patiënten dat erytrocyten, plasma en trombocyten ontvangt.
Bronnen: (Ak, 2009; Avidan, 2004; Girdauskas, 2010; Gonzalez, 2016; Kultufan Turan, 2006; Nuttal, 2001; Paniagua 2011, Schaden, 2012; Shore-Lesserson, 1999; Wang, 2010; Weber, 2012; Westbrook, 2009) |
|
Zeer laag GRADE |
Bloedverbruik - hoeveelheden (eenheden/ml) - erytrocyten, plasma, trombocyten Stollingscorrectie op geleide van TEG/ROTEM vergeleken met standaard laboratoriumtesten heeft wellicht geen effect op het verbruik van erytrocyten, plasma en trombocyten.
Bronnen: (Ak, 2009; Girdauskas, 2010; Gonzalez, 2016; Kultufan Turan, 2006; Paniagua 2011, Royston, 2001; Schaden, 2012; Shore-Lesserson, 1999; Wang, 2010; Weber, 2012; Westbrook, 2009) |
|
Zeer laag GRADE |
Aantal patiënten dat fibrinogeen, PCC en factor VIIa ontvangt We zijn onzeker over het effect van stollingscorrectie op geleide van ROTEM vergeleken met standaard laboratoriumtesten op het aantal patiënten dat fibrinogeen, PCC en factor VIIa ontvangt.
Bronnen: (Girdauskas, 2010; Schaden, 2012; Weber, 2012) |
|
Zeer laag GRADE |
Bloedverbruik - hoeveelheden (eenheden/ml) - fibrinogeen, PCC en factor VIIa We zijn onzeker over het effect van stollingscorrectie op geleide van ROTEM vergeleken met standaard laboratoriumtesten op het totale verbruik in g/U van fibrinogeen, protrombine complex concentraat en factor VIIa.
Bronnen: (Girdauskas, 2010; Schaden, 2012; Weber, 2012) |
|
Laag GRADE |
Chirurgische re-interventie Stollingscorrectie op geleide van TEG en ROTEM vergeleken met standaard laboratoriumtesten leidt mogelijk tot een verminderd aantal chirurgische re-interventies.
Bronnen: (Ak, 2009; Girdauskas, 2010; Nuttal, 2001; Paniagua 2011, Royston, 2001; Shore-Lesserson, 1999; Weber, 2012) |
|
Zeer laag GRADE |
Opnameduur We zijn onzeker over het effect van stollingscorrectie op geleide van ROTEM vergeleken met standaard laboratoriumtesten op de opnameduur.
Bronnen: (Ak, 2009; Gonzalez, 2016; Weber, 2012) |
Samenvatting literatuur
Beschrijving studies
WikkelsØ (2016) heeft in een systematische review het effect van TEG of ROTEM geleide stollingscorrectie vergeleken met standaard laboratoriumtesten geleide stollingscorrectie. Inclusiecriteria waren RCT’s met een parallel design in volwassenen en kinderen met een bloeding. Meta-analyses zijn uitgevoerd voor mortaliteit, bloedverbruik en chirurgische re-interventie. Deze richtlijn is gericht op TEG of ROTEM bij volwassenen, daarom hebben we de studies met kinderen verwijderd uit de meta-analyse (Nakayama, 2015; Cui, 2010). De studie van Kempfert (2011); Rauter (2007) zijn uitsluitend gepubliceerd als een abstract en door de zeer geringe methodologische informatie geëxcludeerd voor deze richtlijn. Uiteindelijk zijn er 13 studies geïncludeerd afkomstig uit deze meta-analyse (tabel 1), waarbij bloedverbruik is gemeten vanaf opname tot ontslag. Wang (2011) heeft mortaliteit gemeten tot 3 jaar, de overige studies hebben dit gemeten tot ontslag uit het ziekenhuis.
Na publicatie van deze meta-analyse heeft Gonzalez (2016) een RCT gepubliceerd over TEG in vergelijking met standaard laboratoriumtesten metingen. Dit betrof trauma patiënten waarbij het protocol massaal bloedverlies direct werd geactiveerd. In 56 patiënten is coagulatie gemeten met TEG en in 55 patiënten met standaard laboratoriumtesten. De mortaliteit is gerapporteerd tot 28 dagen en het aantal patiënten dat bloedproducten ontvangt en het totale bloedverbruik (per soort product) is gemeten tot 24 uur.
Tabel 1 Samenvatting van de geïncludeerde studies
|
|
Indicatie
|
Interventie (ROTEM of TEG) |
Controle |
Aantal patiënten (TEG of ROTEM/ controle) |
|
Ak, 2009 |
Electieve CABG |
TEG |
Klinische besluitvorming en SLT |
114/110 |
|
Avidan, 2004 |
Cardio-thoracale chirurgie |
TEG en plaatjesfunctie test |
SLT |
51/51 |
|
Girdauskas, 2010 |
Cardio-thoracale chirurgie |
ROTEM |
Klinische besluitvorming en SLT |
27/29 |
|
Gonzalez, 2016 |
Trauma |
TEG |
SLT |
56/55 |
|
Kultufan Turan, 2006 |
Cardio-thoracale chirurgie |
TEG |
Klinische besluitvorming en SLT |
20/20 |
|
Nuttal, 2001 |
Cardio-thoracale chirurgie |
TEG en Coagucheck Plus and platelet count (Sysmex) |
Klinische besluitvorming en SLT |
41/51 |
|
Paniagua, 2011 |
Cardio-thoracale chirurgie |
ROTEM |
SLT |
26/18 |
|
Royston, 2001 |
Cardio-thoracale chirurgie |
TEG |
Klinische besluitvorming en SLT |
30/30 |
|
Schaden, 2012 |
Chirurgie na brandwonden |
ROTEM |
Klinische besluitvorming en SLT
|
14/16 |
|
Shore-Lesserson, 1999 |
Cardio-thoracale chirurgie |
TEG |
Klinische besluitvorming en SLT
|
53/52 |
|
Wang, 2011 |
Levertransplantaties |
TEG |
SLT |
14/14
|
|
Weber, 2012 |
Cardio-thoracale chirurgie |
ROTEM en volbloed impedantie-aggregometrie (Multiplate) |
SLT |
50/50 |
|
Westbrook, 2009 |
Cardio-thoracale chirurgie |
TEG en TEG/Platelet mapping |
Klinische besluitvorming en SLT |
32/37 |
* SLT= standaard laboratoriumtesten
Resultaten
Mortaliteit
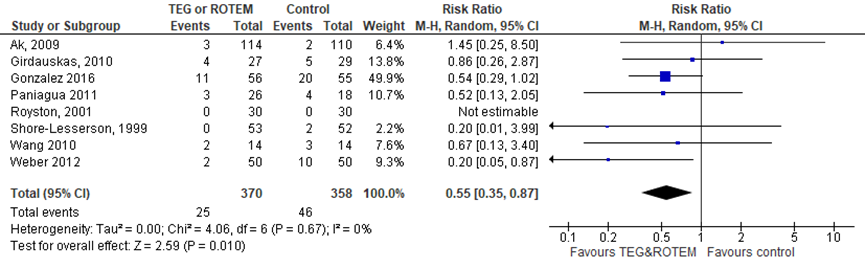
Stollingscorrectie op basis van TEG of ROTEM in vergelijking met standaard laboratoriumtesten verlaagt het risico op mortaliteit (relatief risico (RR) 0,55 (95%-CI: 0,35 tot 0,87) (Figuur 1). Exclusie van de studie die deels gebaseerd is op TEG of ROTEM (Weber, 2012) resulteert in een vergelijkbare RR van 0,61 (95%-CI: 0,38 tot 0,98).
Figuur 1 Het effect van TEG/ROTEM in vergelijking met standaard laboratoriumtesten op mortaliteit
Aantal patiënten dat erytrocyten, plasma en trombocyten ontvangt
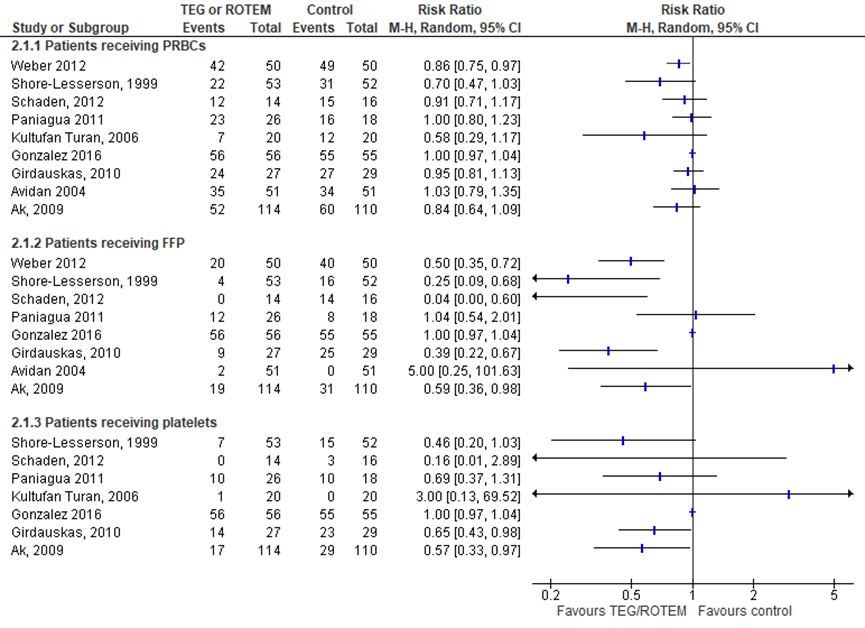
Stollingscorrectie op basis van TEG/ROTEM lijkt geen invloed te hebben op het aantal deelnemers dat erytrocyten, plasma of trombocyten ontvangt (Figuur 2), ondanks dat de meeste studies een trend laten zien in het voordeel van TEG/ROTEM.
De studie van Avidan (2004); Nuttal (2001) en Weber (2012) zijn deels gebaseerd op een plaatjesfunctietest en volbloed impedantie-aggregometrie en daarom uitgesloten voor de analyse op trombocyten. Gezien de grote heterogeniteit is het niet mogelijk de resultaten samen te voegen.
Figuur 2 Proportie van het aantal mensen dat erytrocyten (PRBCs), plasma (FFP) en trombocyten ontvangt gedurende de eerste 24 uur
Hoeveelheid bloedverbruik (in eenheden/ml) voor erytrocyten, plasma en trombocyten
De hoeveelheid bloedverbruik is in verschillende studies gerapporteerd in eenheden of milliliter (ml) zoals weergegeven in tabel 2. Stollingscorrectie op basis van TEG/ROTEM lijkt geen invloed te hebben op bloedverbruik in eenheden/milliliters in vergelijking met de controlegroep.
Tabel 2 Hoeveelheden bloedverbruik in eenheden/milliliter in 24 uur
|
|
TEG/ROTEM |
Controle |
p-waarde |
|
Rode bloedcellen |
|||
|
Ak, 2009 (zakjes) |
1 (0-1) |
1 (1-2) |
0,60 |
|
Avidan, 2004 (zakjes) |
1,8 ± - |
1,9 ± - |
- |
|
Girdauskas, 2010 (zakjes) |
6 (2-13) |
9 (4-14) |
0,20 |
|
Gonzalez, 2016 (zakjes) |
9,5 (5 - 16) |
11,0 (6 – 16) |
0,41 |
|
Kultufan Turan, 2006 (zakjes) |
0 (0-3) |
1 (0-2) |
0,10 |
|
Nuttal, 2001 (zakjes) |
2 (0-9) |
3 (0-70) |
0,04 |
|
Paniagua, 2011 (ml) |
1774 ± 1394 |
1604 ± 1366 |
- |
|
Schaden, 2012 (zakjes) |
3,1 ± 2,1 |
4,8 ± 3,0 |
0,12 |
|
Shore-Lesserson, 1999 (mL) |
354 ± 487 |
475 ± 593 |
0,12 |
|
Wang, 2011 (zakjes) |
14,2 ± 7,1 |
16,7 ± 12,8 |
>0,05 |
|
Weber, 2012 (zakjes) |
3 (2 - 6) |
5 (4 - 9) |
<0,01 |
|
Westbrook, 2009 (zakjes) |
14 (totaal) |
33 (totaal) |
- |
|
Plasma |
|||
|
Ak, 2009 (zakjes) |
1 (1-1) |
1 (1-2) |
0,001 |
|
Avidan, 2004 (zakjes) |
0 ± - |
0,1 ± - |
- |
|
Girdauskas, 2010 (zakjes) |
3 (0-12) |
8 (4-18) |
0,01 |
|
Gonzalez, 2016 (zakjes) |
5,0 (3 - 9) |
6,0 (4 – 9) |
0,51 |
|
Kultufan Turan, 2006 (zakjes) |
2,8 ± 0,95 |
2,7 ± 1,5 |
0,40 |
|
Nuttal, 2001 (zakjes) |
2 (0-10) |
4 (0-75) |
<0,05 |
|
Paniagua, 2011 (ml) |
799 ± 1188 |
707 ± 977 |
- |
|
Royston, 2011 (zakjes) |
5 (totaal) |
16 (totaal) |
- |
|
Schaden, 2012 (zakjes) |
0 (0-0) |
5,0 (1,5-7,5) |
<0,001 |
|
Shore-Lesserson, 1999 (mL) |
36 ± 142 |
217 ± 436 |
<0,05 |
|
Wang, 2011 (zakjes) |
12,8 ± 7,0 |
21,5 ± 12,7 |
<0,05 |
|
Weber, 2012 (zakjes) |
0 (0 - 3) |
5 (3 - 8) |
<0,01 |
|
Westbrook, 2009 (zakjes) |
14 (totaal) |
33 (totaal) |
- |
|
Trombocyten |
|||
|
Ak, 2009 (zakjes) |
1 (1-1) |
1 (1-2) |
0,001 |
|
Girdauskas, 2010 (zakjes) |
2 (2-3) |
2 (2-3) |
0,70 |
|
Gonzalez, 2016 (zakjes) |
1,0 (0 - 2) |
1,0 (0 - 2) |
0,93 |
|
Kultufan Turan, 2006 (zakjes) |
0 (0-4) |
0 (0-0) |
0,41 |
|
Paniagua, 2011 (ml) |
212 ± 307 |
331 ± 406 |
- |
|
Royston, 2011 (zakjes) |
1 (totaal) |
9 (totaal) |
- |
|
Schaden, 2012 (zakjes) |
0 (0-0) |
0 (0-2) |
0,12 |
|
Shore-Lesserson, 1999 (mL) |
34 ± 94 |
83 ± 160 |
0,16 |
|
Wang, 2011 (zakjes) |
27,3 ± 13,9 |
30,1 ± 18,5 |
>0,05 |
|
Westbrook, 2009 (zakjes) |
5 (totaal) |
15 (totaal) |
- |
|
Bloedverbruik is beschreven als het aantal bloedzakjes of milliliter (ml) met gemiddeld ± SD of mediaan (interkwartiel afstand). - indiceert dat er geen SD of p-waarde is gerapporteerd. |
|||
Aantal patiënten dat fibrinogeen, protrombine complex concentraat en Factor VIIa ontvangt
Weber (2012); Girdauskas (2010) en Schaden (2012) hebben gekeken naar het aantal patiënten dat fibrinogeen, protrombine complex concentraat en factor VIIa ontvangt. De resultaten zijn weergegeven in tabel 3.
Tabel 3 Aantal patiënten en verbruik van fibrinogeen, protrombine complex concentraat en Factor VIIa
|
|
TEG/ROTEM |
Controle |
P |
|||
|
|
N (%) |
hoeveelheid |
N (%) |
hoeveelheid |
N (%) |
hoeveelheid |
|
Fibrinogeen (g) |
|
|
|
|
|
|
|
Girdauskas |
78 |
2 (2-3) |
90 |
2 (2-3) |
0,2 |
0,7 |
|
Schaden |
|
8 (totaal) |
|
8 (totaal) |
0,89 |
- |
|
Weber |
64 |
2 (0-4) |
60 |
2 (0-6) |
0,84 |
0,48
|
|
PCC (I.E.) |
|
|
|
|
|
|
|
Girdauskas |
15 |
0 (0–2000) |
90 |
3000 (2000–3000) |
<0,001 |
<0,001 |
|
Schaden |
0 |
- |
0 |
- |
- |
- |
|
Weber |
44 |
1,200 (0-1,800) |
52 |
0 (0-1,800) |
0,43 |
0,16
|
|
Factor VIIa (I.E) |
|
|
|
|
|
|
|
Girdauskas |
4 |
- |
7 |
- |
0,8 |
- |
|
Schaden |
- |
- |
- |
- |
- |
- |
|
Weber |
2 |
0 (0-0 ) |
24 |
0 (0-0) |
0,002 |
0,001 |
Bloedverbruik is beschreven als aantal gram of internationale eenheden (I.E) met een mediaan en interkwartiel afstand - indiceert dat er geen waarde bekend is. PCC = protrombine complex concentraat
Hoeveelheid bloedverbruik (in eenheden/ml) voor fibrinogeen, Protrombine complex concentraat en Factor VIIa
De hoeveelheid bloedverbruik van fibrinogeen, protrombine complex concentraat en Factor VIIa is vergelijkbaar voor stollingscorrectie op basis van TEG/ROTEM in vergelijking met standaard laboratoriumtesten (tabel 3).
Chirurgische re-interventies
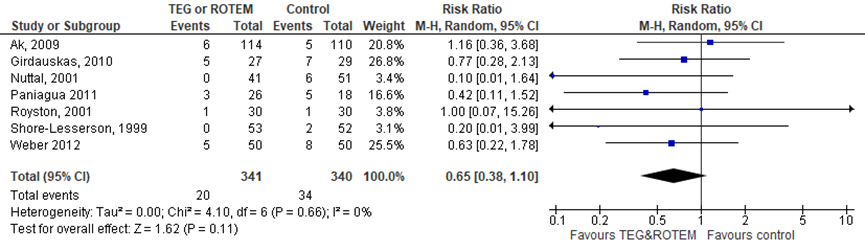
Het aantal chirurgische re-interventies is onderzocht in zeven studies (allen cardiochirurgie) met een gepoolde RR van 0,65 (95%-CI:0,38 tot 1,10) in het voordeel van TEG/ROTEM. Exclusies van de studies die deels gebaseerd zijn op TEG/ROTEM (Nuttal, 2001; Weber, 2012) resulteert in een vergelijkbaar RR van 0,72 (95%-CI: 0,38 tot 1,34).
Figuur 3 Het effect van TEG/ROTEM in vergelijking met standaard laboratoriumtesten op chirurgische re-interventies
Opnameduur
Twee studies hebben gekeken naar de gehele opnameduur en één studie heeft gekeken naar opnameduur op de intensive care. De opnameduur in de studie van Ak (2009) is vergelijkbaar voor stollingscorrectie op basis van TEG (6,2 ± 1,1 dagen) of standaard laboratoriumtesten (6,3 ± 1,4 dagen) (p=0,55). Weber (2012) vindt tevens geen verschil in opnameduur met een mediane opnameduur van 12 dagen bij zowel stollingscorrectie op basis van ROTEM als standaard laboratoriumtesten. Opnameduur op de intensive care is tevens vergelijkbaar in de TEG groep in vergelijking met de controlegroep, met een mediane opnameduur van respectievelijk 18 en 16 dagen (p=0,08) (Gonzalez, 2016).
Bewijskracht van de literatuur
De bewijskracht voor RCTs begint hoog en is voor de uitkomstmaat mortaliteit met twee niveaus verlaagd tot laag gezien beperkingen in het geringe aantal patiënten (imprecisie) en tegenstrijdige resultaten (inconsistentie).
De bewijskracht voor de uitkomstmaat bloedverbruik (erytrocyten, plasma, trombocyten) is met drie niveaus verlaagd tot zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias); tegenstrijdige resultaten (inconsistentie) en het geringe aantal patiënten (imprecisie). Het verbruik van fibrinogeen, protrombine complex concentraat en factor VIIa is maar in één studie onderzocht, en daarom met een extra niveau verlaagd voor imprecisie.
De bewijskracht voor de uitkomstmaat chirurgische re-interventie is met twee niveaus verlaagd tot laag gezien beperkingen in de onderzoeksopzet (risk of bias) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat opnameduur is met drie niveaus verlaagd tot zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias) en met twee niveaus verlaagd voor imprecisie, aangezien het maar in 3 studies is onderzocht.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende vraag:
Wat is het effect van stollingscorrectie op geleide van coagulopathie gemeten met TEG of ROTEM in vergelijking met stollingscorrectie op geleide van coagulopathie gemeten met standaard laboratoriumtesten of klinische besluitvorming bij volwassenen met:
- een verbloedingsshock;
- of, een acute bloeding bij electieve ingrepen?
Relevante uitkomstmaten
Mortaliteit, morbiditeit, complicaties ten gevolge van transfusie, bloedverbruik (erytrocyten, plasma, trombocyten, fibrinogeen, protrombine complex concentraat, factor VIIa), chirurgische re-interventies en opnameduur.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 20 november 2018 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerde studies (RCT’s). De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 419 treffers op. Studies werden geselecteerd op grond van de volgende criteria: studies naar stollingscorrectie gemeten met TEG of ROTEM in vergelijking met standaard laboratoriumtesten en klinische besluitvorming, uitgevoerd in volwassenen en gepubliceerd vanaf de zoekdatum (januari 2016) van de meta-analyse van WikkelsØ. Op basis van titel en abstract werden 54 studies geselecteerd. Na raadpleging van de volledige tekst, werden 52 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en twee studies definitief geselecteerd.
Uiteindelijk zijn er twee onderzoeken opgenomen in de literatuuranalyse (WikkelsØ, 2016; Gonzalez, 2016). Alle studies met stollingscorrectie op basis van standaard laboratoriumtesten en klinische besluitvorming zijn geïncludeerd in deze richtlijn. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Avidan, M. S., Alcock, E. L., Da Fonseca, J., Ponte, J., Desai, J. B., Despotis, G. J., & Hunt, B. J. (2004). Comparison of structured use of routine laboratory tests or near‐patient assessment with clinical judgement in the management of bleeding after cardiac surgery. British journal of anaesthesia, 92(2), 178-186.
- Baksaas-Aasen, K., Gall, L., Eaglestone, S., Rourke, C., Juffermans, N. P., Goslings, J. C., ... & Maegele, M. (2017). iTACTIC–implementing Treatment Algorithms for the Correction of Trauma-Induced Coagulopathy: study protocol for a multicentre, randomised controlled trial. Trials, 18(1), 486.
- Gonzalez, E., Moore, E. E., Moore, H. B., Chapman, M. P., Chin, T. L., Ghasabyan, A., ... & Burlew, C. C. (2016). Goal-directed hemostatic resuscitation of trauma-induced coagulopathy: a pragmatic randomized clinical trial comparing a viscoelastic assay to conventional coagulation assays. Annals of surgery, 263(6), 1051.
- Nakayama, Y., Nakajima, Y., Tanaka, K. A., Sessler, D. I., Maeda, S., Iida, J., ... & Mizobe, T. (2014). Thromboelastometry-guided intraoperative haemostatic management reduces bleeding and red cell transfusion after paediatric cardiac surgery. British journal of anaesthesia, 114(1), 91-102.
- Paniagua, P., Koller, T., Requena, T., Gil, J. M., Campos, J. M., & Galan, J. (2011). Randomized controled trial to evaluate postoperative coagulation management with bed-side trombelastometry (Rotem) compared with a transfusion protocol based on laboratory meausurments in bleeding patients after cardiac surgery: Preliminary data: 6AP6-4. European Journal of Anaesthesiology (EJA), 28, 94.
- Wang, S. C., Shieh, J. F., Chang, K. Y., Chu, Y. C., Liu, C. S., Loong, C. C., ... & Tsou, M. Y. (2010, September). Thromboelastography-guided transfusion decreases intraoperative blood transfusion during orthotopic liver transplantation: randomized clinical trial. In Transplantation proceedings (Vol. 42, No. 7, pp. 2590-2593). Elsevier.
- Weber CF, Görlinger K, Meininger D, Herrmann E, Bingold T, Moritz A, Cohn LH, Zacharowski K. Point-of-care testing: a prospective, randomized clinical trial of efficacy in coagulopathic cardiac surgery patients. Anesthesiology. 2012 Sep;117(3):531-47. PubMed PMID: 22914710.
- Wikkelsø, A., Wetterslev, J., Møller, A. M., & Afshari, A. (2016). Thromboelastography (TEG) or thromboelastometry (ROTEM) to monitor haemostatic treatment versus usual care
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Gonzalez, 2016 |
Type of study: RCT
Setting and country: academic level-1 trauma center, USA
Funding and conflicts of interest: Nothing to declare
|
Inclusion criteria: > 18 years of age and MTP activation upon ED arrival: SBP <70 mm Hg or SBP 70–90 mm Hg with HR ≥108 beats/min in addition to any of the following injury patterns: penetrating torso wound, unstable pelvic fracture, or abdominal ultrasound suspicious of bleeding in more than one region.
Exclusion criteria: 1) prisoners 2) pregnant women
N total at baseline: Intervention: 56 Control: 55
Important prognostic factors2: Age, median (IQR) I: 41 (28-54) C: 38 (25-53)
Sex: I: 66.0 % M C: 74.5 % M
Groups comparable at baseline? The groups were similar regarding demographics, injury severity, clinical, laboratory and coagulations characteristics
|
Describe intervention (treatment/procedure/test):
TEG (activated clotting time; angle; maximum amplitude; percent clot lysis 30 minutes after reaching MA)
- The first TEG variable reported is activated clotting time (ACT); if ACT ≥140 s, patients receive 2 plasma units, 10-pack of cryoprecipitate, and 1 unit of apheresis platelets. If ACT 111-139 s, only 2 units of plasma were given. - For subsequent TEGs, an ACT > 110 s triggered transfusion of 2 plasma units; - angle less than 63 degrees? a 10-pack of cryoprecipitate; - maximum amplitude (MA) < 55 mm? 1 apheresis platelet unit, and LY30 equal or greater than 7.5% administration of tranexamic acid (1 g, intravenous).
|
Describe control (treatment/procedure/test):
INR, PTT, fibrinogen and D-dimer
- INR equal or greater than 1.5 = 2 units of plasma; - fibrinogen less than 150 mg/dL = 10-pack of cryoprecipitate; - platelet count less than 100,000/μL = 1 unit of apheresis platelets. - Antifibrinolytic medication (tranexamic acid, 1 g, intravenous) was administered in the setting of suspicion of fibrinolysis with an elevated D-dimer (>0.5 μg/mL). |
Length of follow-up: 28 days
Loss-to-follow-up: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Survival (28 days) TEG versus CCA, HR 2.17 (95%-CI:1.03-4.58).
Mortality (28 d) I: 11 (19.6%) C: 20 (36.4%) P=0.049
RR: 0.54, p<0.05
PRBC (24h) n, median (IQR) I: 48/56, 9.5 (5-16) C: 40/55, 11.0 (6-16) P=0.41
Plasma (24h) n, median (IQR) I: 48/56, 5.0 (3-9) C: 40/55, 6.0 (4-9) P=0.51
Platelets (24h) n, median (IQR) I: 48/56, 1.0 (0-2) C: 40/55, 610 (0-2) P=0.93 |
|
|
WikkelsØ, 2016
|
SR and meta-analysis of RCTs Literature search up to January 2016
A: Ak, 2009 B: Avidan, 2004 C: Girdauskas, 2010 D: Kultufan Turan, 2006 E: Nuttal, 2001 F: Paniagua, 2011 G: Royston, 2001 H: Schaden, 2012 I: Shore-Lesserson, 1999 J: Wang, 2010 K: Weber, 2012 L: Westbrook, 2009
Study design: RCT (parallel)
Setting and Country:
A: Turkey B: United Kingdom C: Germany D: Turkey E: USA F: Spain G: United Kingdom H: Austria I: USA J: Taiwan K: Germany L: Asutralia
Source of funding and conflicts of interest:
B: not for profit C: unclear D: not for profit E: not for profit F: not for profit G: unclear H: funded by independent funds, but one author declared relation to TEM innovations I: not for profit J: not for profit K: funded by independent funds, but two authors declared to have received speakers’ honoraria from TEM innovations L: unclear
|
Inclusion criteria SR: trials with adults and children who were bleeding.
Exclusion criteria SR: -
N (Intervention/Control)
A: 114/110 B: 51/51 C: 27/29 D: 20/20 E: 41/51 F: 26/18 G: 30/30 H: 14/16 I: 53/52 J: 14/14 K: 50/50 L:
|
Describe intervention:
A: TEG B: TEG and the PFA-100 platelet function analyser C: ROTEM D: TEG E: TEG F: ROTEM-guided transfusion algorithm G: TEG H: ROTEM I: TEG J: monitored during surgery using point-of-care TEG analysis K: point-of-care testing guided algorithm based on ROTEM and whole blood impedance aggregometry L: TEG
|
Describe control:
A: clinician-directed transfusion B: algorithm based on routine laboratory assays C: Routine transfusion practices D: outine transfusion practices E: clinician-directed transfusion F: standard laboratory coagulation testing G: clinical discretion and standard laboratory tests H: clinical discretion I: routine transfusion therapy and standard laboratory coagulation testing J: standard laboratory measures of blood coagulation K: algorithm based on standard laboratory tests L: clinical discretion and standard laboratory tests
|
End-point of follow-up:
A: Follow-up: unclear, but transfusion requirements were recorded until discharge from hospital and mortality until 30 days B: 24 hours C: hospital discharge (blood products 24 hours) D: 24 hours E: unclear, but transfusion requirements were reported for the entire hospital stay. F: until stopped bleeding for primary outcome and until discharge on mortality G: unclear, but transfusion requirements and mortality data were reported for 2 days postoperatively H: discharge from ICU I: until hospital discharge, but transfusion requirements were reported for 2 days postoperatively J: 3 years K: mortality – 6 months, other outcomes: 24 hours L: until hospital discharge
For how many participants were no complete outcome data available? (intervention/control)
A: appears complete B: No lost to follow-up C: appears complete D: appears complete E: appears complete F: stopped before completion due to slow inclusion (52/100) – but no lost to follow up G: appears complete H: appears complete I: appears complete J: appears complete K: Complete data, but terminated early due to an interim analysis at 50% of the planned sample size L: appears complete
|
Mortality Defined as: overall mortality, using the longest follow-up data from each trial.
RR (95% CI):
A: Ak, 2009 B: Avidan, 2004 C: Girdauskas, 2010 D: Kultufan Turan, 2006 E: Nuttal, 2001 F: Paniagua, 2011 G: Royston, 2001 H: Schaden, 2012 I: Shore-Lesserson, 1999 J: Wang, 2010 K: Weber, 2012 L: Westbrook, 2009
A: 0.52 (0.13-2.05) B: 0.67 (0.13-3.40) C: 0.20 (0.05-0.87)
Pooled effect (FE models) RR: 0.36 (95%-CI: 0.16-0.84) favoring TEG or ROTEM Heterogeneity (I2): 0.0%
Amount of blood products transfused
Packed red blood cells RR (95% CI): A: 1.00 (0.80-1.23) C: 0.86 (0.75-0.97)
Pooled effect (FE models) RR: 0.91 (95%-CI: 0.83-1.00) favoring TEG or ROTEM Heterogeneity (I2): 0.0%
Frozen Fresh Plasma RR (95% CI): A: 1.04 (0.54-2.01) C: 0.50 (0.35-0.72) D: 5.00 (0.75-101.63)
Pooled effect (FE models) RR: 0.83 (95%-CI: 0.49-1.40) favoring TEG or ROTEM Heterogeneity (I2): 0.0%
Platelets RR (95% CI): A: 0.69 (0.37-1.31) C: 0.85 (0.62-1.16)
Pooled effect (FE models) RR: 0.87 (95%-CI: 0.68-1.11) favoring TEG or ROTEM Heterogeneity (I2): 0.0% |
|
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Ak, 2009 |
Randomization based on clinic record number. |
Likely |
Unlikely
Patients could not influence the treatment or results.
|
Unlikely Transfusions were performed by the anaesthesiologist who was blinded to the patient’s group assignment. |
Mortality: unlikely Transfusion: unclear |
Unlikely
Unable to compare with protocol or trial registration but appears to be free of selective reporting |
Unlikely
There appears to be complete follow-up. |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
|
Avidan, 2004 |
No information provided |
Unlikely
Sealed envelopes |
Unlikely
Patients could not influence the treatment or results.
|
Mortality: Unlikely Blood transfusion: Unclear
Those measuring the outcomes were blinded, investigators are not blinded. Unclear whether care providers were blinded, but unlikely that this influenced the mortality rates. |
Unlikely
Those measuring and documenting postoperative bleeding and thus in charge of outcome assessment were blinded to group allocation. Point-of-care haemostatic tests were also run for the control group, but investigators were blinded to the results |
Unlikely
Unable to compare with protocol or trial registration but appears to be free of selective reporting |
Unlikely
There appears to be complete follow up. |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
|
Girdauskas, 2010 |
Computer-generated randomization list, random computer number generator |
Unlikely |
Unlikely
Patients could not influence the treatment or results.
|
Likely
No blinding. |
Likely
No blinding. |
Unlikely
Unable to compare with protocol or trial registration, but appears to be free of selective reporting |
Unlikely |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
|
Gonzalez, 2016 |
Weekly alternation of the 2 treatment modalities was used. |
Likely
Weekly alternation of the 2 treatment modalities was used. |
Unlikely
Patients could not influence the treatment or results.
|
Mortality: Unlikely Blood transfusion: Likely
Managing clinicians only had access to the tests assigned to the study group and were blinded to the other tests, but unlikely that this influenced the mortality rates. |
Mortality: Unlikely Blood transfusion: Unclear
No information provided regarding outcome assessors, but unlikely that this influenced the mortality rates. |
Unlikely
Clinical trial NCT01536496. Comparing with trial registration we found no indications of selective reporting |
Unlikely
There appears to be complete follow up. |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
|
Kultufan Turan, 2006 |
Unclear |
unclear |
Unlikely
Patients could not influence the treatment or results.
|
Unclear
The doctor in charge of performing the ROTEG and the medical doctor in the ICU were blinded. However, it is unclear if the anaesthesiologist in charge of transfusion perioperatively were blinded to the group allocation |
Unclear |
Unlikely
Unable to compare with protocol or trial registration but appears to be free of selective reporting |
unclear |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
|
Nuttal, 2001 |
Computer-generated randomization list with a block size of four to one of two groups |
Unlikely |
Unlikely
Patients could not influence the treatment or results. |
Unlikely
The people making the transfusion decisions were blinded to group designation of the patients until after the determination of abnormal bleeding after CPB |
Unclear |
Unlikely
Unable to compare with protocol or trial registration, but appears to be free of selective reporting |
Unlikely
Adequate follow-up. |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
|
Paniagua, 2011 |
Computer generated |
Unlikely
Sealed envelopes |
Unlikely
Participants were blinded |
Mortality: Unlikely Blood transfusion: Likely
Care providers were not blinded, unlikely that this influenced the mortality rates. |
Mortality: Unlikely Blood transfusion: Likely
Outcome assessors were not blinded, but unlikely that this influenced the mortality rates. |
Unlikely
Clinical trials registration: NCT01919840. Appears free of selection bias. |
Likely
No patients were lost to but terminated before time due to slow inclusion (52/100). |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
|
Royston, 2001 |
Unclear |
Unlikely
Sealed envelope. |
Unlikely
Patients could not influence the treatment or results. |
Mortality: Unlikely Blood transfusion: unclear
No information provided |
Mortality: Unlikely Blood transfusion: unclear
|
Unlikely
Unable to compare with protocol or trial registration but appears to be free of selective reporting |
Unlikely
Adequate follow up |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
|
Schaden, 2012 |
By date of admission. |
Likely
|
Unlikely
Patients could not influence the treatment or results. |
Likely
No blinding |
Likely
No blinding |
Unlikely
No trial registration available, unable to assess selective outcome reporting because of the overall quality of the trial and publication |
Unlikely
Complete follow up |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
|
Shore-Lesserson, 1999 |
Central generation of table of random numbers. |
Unlikely
Sealed envelopes |
Unlikely
Patients could not influence the treatment or results. |
Unlikely
Data entry person was blinded to group assignment. Transfusions in the ICU after the first postoperative hour were performed at the discretion of the ICU physician, who was blinded to the patient’s group assignment |
Unlikely |
Unlikely
Yes. Unable to compare with protocol or trial registration but appears to be free of selective reporting |
Unlikely
Adequate follow up |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
|
Wang, 2010 |
No information provided |
Unclear
No information provided |
Unlikely
No information provided, but patients could not influence the treatment or results. |
Mortality: Unlikely Blood transfusion: Likely
No information provided, but adequate blinding appears highly unlikely, but unlikely that this influenced the mortality rates. |
Mortality: Unlikely Blood transfusion: Likely
No information provided and adequate blinding appears highly unlikely, but unlikely that this influenced the mortality rates. |
Unlikely
Unable to compare with protocol or trial registration but appears to be free of selective reporting |
Unlikely
Appears to have adequate follow-up |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
|
Weber, 2012 |
Computer-generated using a balanced (allocation ratio 1:1) block wise (20x10) randomizations |
Unlikely Central allocation |
Unlikely
Patients could not influence the treatment or results.
|
Mortality: Unlikely Blood transfusion: Likely
No blinding was performed, but unlikely that this influenced the mortality rates. |
Mortality: Unlikely Blood transfusion: Likely
No blinding was performed, but unlikely that this influenced the mortality rates. |
Unlikely
Clinical trial NCT00997841. Comparing with trial registration we found no indications of selective reporting |
Likely
Complete data, but terminated early due to an interim analysis at 50% of the planned sample size |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
|
Westbrook |
Unclear |
Unclear |
Unlikely
Patients could not influence the treatment or results.
|
Unclear |
Unclear |
Unlikely
Unable to compare with protocol or trial registration but appears to be free of selective reporting |
Unlikely
Appears adequate follow up |
Unlikely
Intention to treat is not an issue, no contamination could occur. |
Tabel Exclusie na het lezen van het volledige artikel
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 15-10-2020
Laatst geautoriseerd : 15-10-2020
Geplande herbeoordeling : 01-01-2026
Voor het beoordelen van de actualiteit van deze richtlijn wordt een deel van de werkgroep in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het afronden van de richtlijn zal de werkgroep per module een inschatting maken over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging (NIV), Nederlandse Vereniging van Anesthesiologie (NVA) en Nederlandse Vereniging van Klinische Chemie (NVKC) zijn regiehouders van deze richtlijn(module) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(module). De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Stollingscorrectie op basis van TEG/ROTEM |
|
|
Bij publicatie van de iTACTIC studie de module moet worden herzien. |
|
|
|
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De transfusierichtlijn geeft ten eerste antwoorden op grote uitgangsvragen over wie, wanneer, hoe, hoeveel en met welke producten getransfundeerd wordt en wat daarvan volgens wetenschappelijk onderzoek aan voordelig/nadelig resultaat verwacht mag worden. Na het bepalen van de wetenschappelijke waarde van dit onderzoek, worden uiteindelijk aanbevelingen opgesteld, gebaseerd op de conclusies van het wetenschappelijke onderzoek en na het beschouwen van een additionele context van bijvoorbeeld kosten- ethische, maatschappelijke of wettelijke overwegingen. Deze aanbevelingen zijn bedoeld om verantwoord en wenselijk handelen voor leden van de beroepsgroep te definieren in de voorkomende dagelijkse klinische praktijk. Echter, er kan beargumenteerd altijd afgeweken worden van de algemene aanbevelingen en gekozen worden voor een meer op de individuele patient afgestemde ondersteuning.
Doelgroep
Naast de genoemde beoogde gebruikers van de richtlijn is de richtlijn ook bedoeld en van waarde voor de collega’s van de nationale bloedvoorzieningsorganisatie Sanquin.
Samenstelling werkgroep
Voor de herziening van de richtlijn zijn er in 2016 zes multidisciplinaire werkgroepen ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij patiënten die een bloedtransfusie nodig hebben. Een stuurgroep, bestaande uit de voorzitters van de deelprojecten, coördineerde de werkgroepen.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep bloedingen en bloedbesparende technieken:
- Dr. A.W .M.M. (Ankie) Koopman- van Gemert, Anesthesioloog, voorzitter, NVA
- Dr. P.M.J. (Peter) Rosseel, anesthesioloog-intensivist, NVA
- Prof. dr. J.J. (Jaap Jan) Zwaginga, Hematoloog / Transfusiespecialist / Hoogleraar transfusiegeneeskunde, NIV
- Prof. dr. F.W.G. (Frank) Leebeek, Internist hematoloog en internist vasculair geneeskundige, NIV
- Dr. ir. Y.M.C. (Yvonne) Henskens, laboratoriumspecialist klinische chemie/ clusterhoofd Hemostase en Transfusie, NVKC
- Dr. E.C.T.H. (Edward) Tan, Traumachirurg / Afdelingshoofd SEH / Heli-MMT arts, NVVH
- Dr. L.M.G. (Leo) Geeraedts, Traumachirurg, NVVH
- Dr. A.B.A. (Alexander) Vonk, Cardiothoracaal chirurg, NVT
- Drs. E.J. (Elise) Huijssen-Huisman, Kinderarts, kinderhematoloog, Transfusiespecialist, NVK
- Dr. N.P. (Nicole) Juffermans, Intensivist, NVIC
- Dr. J.J. (Hans) Duvekot, Gynaecoloog-Perinatoloog, NVOG
Meelezer:
- Drs. V.A. (Victor) Viersen, Anesthesioloog, NVA
Werkgroep Transfusiereacties en gerelateerde aandoeningen:
- Dr. M.R. (Martin) Schipperus, internist-hematoloog, voorzitter, NIV
- Dr. J.L.P. (Hans) van Duijnhoven, laboratoriumspecialist klinische chemie, NVKC
- Drs. C.T. (Christian) Favoccia, anesthesioloog, NVA
- Prof dr. C.J. (Karin) Fijn van Draat, hoogleraar kinderhematologie/ senior onderzoeker Sanquin research, NVK
- G.H. (Judith) Lie, hemovigilantiefunctionaris, weefselvigilantiecoördinator, NVML
- Dr. T. (Tanja) Netelenbos, internist-hematoloog, NIV
- M.R. (Michaela) van Bohemen, verpleegkundige n.p., hemovigilantieconsulent V&VN (vanaf juli 2018)
- Dr. J. (Jennita) Slomp, laboratoriumspecialist klinische chemie en hematologie, NVKC
- Dr. D. (Dik) Versteeg, arts-microbioloog, NVMM (tot juli 2018)
- Dr. J. H. (Jan) Marcelis arts-microbioloog, NVMM (vanaf juli 2018)
- Dr. A.P.J. (Alexander) Vlaar, internist-Intensivist, NVIC
- Dr. J.C. (Jo) Wiersum-Osselton, TRIP hemo- en biovigilantie, landelijk coördinator, arts M&G, NVDG
Voor de module “Indicatie voor bestralen van bloedproducten” heeft een expertmeeting plaatsgevonden. Bijzondere dank aan de experts die tijdens en na deze meeting hebben bijgedragen aan de tekst:
- Prof. dr. J.H.F. (Fred) Falkenburg, hoogleraar hematologie
- Dr. P.A.W. (Peter) te Boekhorst, internist-hematoloog/ transfusiespecialist
- Drs. K.A. (Klasien) Bergman, kinderarts-neonatoloog
- Prof. dr. J.J. (Jaap Jan) Zwaginga, internist-hematoloog/ transfusiespecialist/ hoogleraar transfusiegeneeskunde
- Dr. M.D. (Mette) Hazenberg, internist-hematoloog
Met ondersteuning van:
- Drs. E.E. (Eva) Volmeijer, adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider (tot februari 2020)
- Dr. B.H. (Bernardine) Stegeman, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten, projectleider (vanaf februari 2020)
- Drs. T. (Tessa) Geltink, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. (Roy) Elbers, adviseur Kennisinstituut van de Federatie Medisch Specialisten (tot juli 2019)
- Dr. E. (Ellen) Paap, adviseur Kennisinstituut van de Federatie Medisch Specialisten (vanaf juli 2019)
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Voorzitters (kerngroep) |
||||
|
M. Schipperus |
Internist-hematoloog (100%) |
Voorzitter Bestuur Stichting TRIP (Transfusie in patiënten), onbetaald |
ITP-onderzoek gefinancierd door AMGeN Advisory board Novartis |
Lid participeert niet in besluitvorming omtrent producten van AMGEN of Novartis. |
|
A. Koopman- van Gemert |
Anesthesioloog |
Diverse functies bij nationale en internationale commissies bv Concilium, Stuurgroep antistolling, examencommissie et cetera Internationaal lid van de Europese examencommissie |
-Participatie in de PETS-studie van het EMC, geen financiële relatie. -Participatie in verschillende onderzoeken (geen financiële relatie en geen direct verband bloedtransfusie) -Organisatie symposia met sponsoring (geen directe financiële relatie en direct verband bloedtransfusie) |
Geen restricties |
|
J.J. Zwaginga |
Hematoloog LUMC (Leiden), Transfusiespecialist, Hoogleraar transfusiegeneeskunde |
-Penningmeester VHL=Vereniging Hematologische laboratoria -Voorzitter van de benigne hematologische werkgroep van NVvH |
-Sprekershonoraria Viforpharma (ijzer: medicatie kan transfusies uitsparen) -Wetenschappelijke adviesraad: Novantis (ijzerchelatie kan transfusie gemedieerde ijzerstapeling opheffen) - Gilead: CLL medicatie webcast geen relatie met transfusiebeleid PI van meerdere Sanquin onderzoeken ogv - allumminisatie door RBC transfusies - ijzertoxiciteit door bloedtransfusies - bloedings IRM (voldoende) plaatjestransfusies et cetera |
Lid participeert niet in besluitvorming omtrent Novartis en wanneer SANQUIN-studies worden geïncludeerd waarbij lid een van de auteurs is |
|
E. Beckers |
Internist-hematoloog/transfusiespecialist MUMC + Maastricht |
Bestuurslid Ned. Ver. Bloedtransfusie, onbetaald - Bestuurslid Ned. Ver. Hematologie, onbetaald - Lid adviesraad TRIP (Transfusie Reacties in Patiënten), onbetaald - Lid Landelijke Gebruikers Raad Sanquin, onbetaald - Lid Stuurgroep TiN studie (Trombocytopathie in Nederland) |
Project 'Predictors of Bleeding' externe financiering door Bayer
Transparantieregister.nl: sprekers vergoeding van Roche; gastvrijheidsbijdrage van: Roche, Pfizer, Sanquin en Bayer |
Lid participeert niet in besluitvorming omtrent producten van Bayer en Roche en wanneer specifiek de studie "predictors of bleeding" (gefinancierd door Bayer) worden geïncludeerd |
|
J. Slomp |
Laboratorium specialist Klinische Chemie en hematologie MST/Medlon |
-Bestuurslid VHL - onbetaald -Bestuurslid NVvH - onbetaald -Werkgroep Bloedtransfusie VHL (vz.) onbetaald -Lid LGR onbetaald - - Lid Expert committee TRIP (onbetaald) |
-Medical Advisory Board Janssen: advies omtrent bloedtransfusie bij patiënten die daratumumab gebruiken, betaald - In samenwerking met UMCU en VU bezig om een landelijk protocol op te stellen voor bloedtransfusie en daratumumab |
Lid participeert niet in besluitvorming omtrent productn van Janssen (daratumumab) |
|
H. Soons |
Laboratoriumspecialist Klinische Chemie, St. Anna Ziekenhuis (1 fte) en Kempenhaeghe (detachering vanuit St. Anna Ziekenhuis)
|
-Bestuur Nederlandse Vereniging voor Bloedtransfusie (NVB), voorzitter, onbetaald -Bestuur Transfusie Reacties in Patiënten (TRIP), secretaris, vacatiegeld - Medisch Advies Raad Sanquin (MAR), lid, vacatiegeld -Lid Landelijke Gebruikersraad Sanquin (LGR), onbetaald |
|
Geen restricties |
|
Werkgroep laboratoriumaspecten |
||||
|
H. de Wit |
Laboratoriumspecialist Klinische Chemie en Hematologie, Certe |
-Bestuurslid/ penningmeester Nederlandse Vereniging voor Bloedtransfusue (onbetaald) - Bestuurslid/ penningmeester Stichting Vrienden van de NVB (onbet aald) |
|
Geen restricties |
|
K. de Vooght |
Laboratoriumspecialist Klinische Chemie, Hoofd Patiëntenzorg LKCH ad interim |
Bestuurslid/ penningmeester Stichting TRIP (onbetaald) - Bestuurslid/voorzitter Stichting vrienden van de Utrechtse bloedbank (onbetaald) - Lid Werkgroep Consortium Transfusiegeneeskundig Onderzoek (onbetaald) - Lid PROTON II Adviesraad (onbetaald) - Lidmaatschap NVB - Lidmaatschap NVvH - Docent OKU (Onderwijs Kring Utrecht) (betaald) -Docent PAO Farmacie (betaald) -Lid Wetenschappelijke commissie NVB/TRIP symposium (onbetaald) |
|
Geen restricties |
|
C. Folman |
Manager Laboratorium Erytrocytenserologie (Sanquin) |
- Docent Hogeschool Arnhem en Nijmegen, betaald - Lid TRIX-werkgroep, onbetaald - Secretaris werkgroep Bloedtransfusie van de VHL (Vereniging Hematologische Laboratoriumdiagnostiek), onbetaald - Lid Expert Committee TRIP (Transfusie Reacties In Patiënten), onbetaald -Lid wetenschappelijke commissie NVB (Nederlandse Vereniging voor Bloedtransfusie), onbetaald" |
- Dienstverband Sanquin - werkzaam in expertiselaboratorium waar onderzoek wordt gericht voor derden op het gebied van bloedtransfusie |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
M. de Haas |
-Bijzonder hoogleraar Translationele Immunohematologie (bezoldiging Sanquin, onbezoldigd aangesteld bij LUMC -Clustermanager Immunohematologie Diagnostiek |
- Secretaris NVB (tot mei 2017) |
-Dienstverband Sanquin -Hoofd van een expertiselaboratorium dat ingezet zou kunnen worden door derden voor het uitvoeren van (uit de richtlijn voortkomende) laboratoriumdiagnostiek |
Werkgroeplid is geen trekker/primaire auteur bij uitspraken over diagnostiek.
|
|
H. Russcher |
Laboratoriumspecialist Klinisch Chemie en Hematologie, in het Erasmus MC en Havenziekenhuis |
- Auditor RvA i.h.k.v. ISO 15189:2012 voor medische laboratoria - Betaald |
|
restricties t.a.v. producten van Roche diagnostiek.Gebruikersraad geen belangen tav Sanquin, geen restriicties |
|
N. Som |
Senior hoofdanaliste bloedtransfusiedienst VUmc |
- Hemovigilantiecoördinator Vumc |
|
Geen restricties |
|
J. Lie |
-Stafadviseur hemovigilantie 24,8 uur -Weefselvigil antiecoördinator 7,2 uur" |
-Contactpersoon voor landelijk Bureau TRIP: meldingen transfusiereacties en bijwerkingen - Voorzitter landelijk Hemovigilantoe Platform Nederland (vanaf 2016, eerder lid, mede oprichter HPN), onbetaald - Voorzitter en oprichter Regionaal Hemovigilantie Platform Zuidoost - BestuursLid NVB |
|
Geen restricties |
|
Werkgroep Anemie |
||||
|
A. Van Gammeren |
Laboratoriumspecialist Klinische Chemie
|
|
|
Geen restricties
|
|
N. Juffermans |
Intensivist |
Chief editor Netherlands Journal of Critical Care, vergoeding |
|
Geen restricties
|
|
K. Bergman |
Kinderarts-neonatologie, Beatrix kinderziekenhuis, UMCG ten Groningen (0,9fte). Als kinderarts-neonatologie voorzitter van het Regioteam Perinatale Audit Noord Nederland (Perined). Deze functie (0,1fte) wordt uitgeoefend binnen de UMCG aanstelling. |
-Lid programmacommissie Prenatale screening infectieziekten en erytrocyten-immunisatie RIVM namens NVK (vacatiegeld) -Lid werkgroep neonatale infectieziekten sectie neonatologie NVK (onbetaald) -Projectcommissielid ZonMw project: Introduction of Audit generated Changes in perinatal care using ""Tailored"" implementation strategies. (ACTion-project) (onbetaald) =Projectcommissielid 5 genes per minute, afdeling Medische genetica, UMCG, Groningen (onbetaald) |
|
Geen restricties
|
|
P. te Boekhorst |
Internist-Hematoloog / Transfusiespecialist
|
Medisch Adviesraad Sanquin, Lid, Vacatiegeld
|
In verleden: - Gastvrijheid Firma Alexion - Adviesraad Firma AmgeN (ITP) |
Lid participeert niet bij besluitvorming omtrent ITP |
|
B. Biemond |
Internist-hematoloog |
|
|
Geen restricties |
|
L. Oosten |
Hematoloog, Afdeling Immunohematologie & Bloedtransfusie bij het Leids Universitair Medisch Centum |
|
|
Geen restricties |
|
K. Fijn van Draat |
-Hoogleraar kinderhematologie AMC - Senior onderzoeker Sanquin Research |
VIDI selectiecommissie ZONMW, onbetaald (wel vacatievergoeding) |
Lid van de stuurgroep van de PLANET-2 studie die onderzoek doet naar triggers van trombocytentransfusie bij neonatenop de Neonatale Intensive Care Unit. PLANET-2 ontvangt geen sponsoring van de farmaceutische industrie |
Geen restricties |
|
Werkgroep trombocytentransfusies |
||||
|
A. Vlaar |
- Internist-Intensivist, Academisch Medisch Centrum, Amsterdam - Principal investigator Infusion related morbidity and mortality in the critically ill |
- Klinisch brug figuur Sanquin, onbetaald
|
Onderzoek gefinancierd door NWO, ZonMW, Sanquin: PI van de PACER studie (onder andere): hierbij worden trombotriggers voor invasieve ingrepen aangehouden. |
Geen restricties (ten aanzien van PACER studie: geen tegengesteld belang. Studie wordt niet gepubliceerd binnen termijn afronding richtlijn). |
|
l. van Pampus |
Internist-hematoloog-transfusiespecialist Radboudumc |
- Vice voorzitter hemovigilantiekamer TRIP (onbezoldigd)
|
Tegemoetkoming verblijfkosten Dublin (Ierland) het 17th Annual NATA Symposium on Patient Blood Management, Haemostasis and Thrombosis (NATA 2016) cf de CGR-rgels. |
Geen restricties |
|
G. Jansen |
Internist-hematoloog, afdeling Hematologie, Erasmus MC |
Post doctoraal onderzoeker bij afdeling Plasmaeiwitten, Sanquin Bloedvoorziening. Gastvrijheidovereenkomst, onbetaald |
"1) Naam project: ""Surface sialic acid is critical for platelet survival"" Financier: Sanquin Product and Process development (PPOC nr. 13-019). Bedrag: 499.000 euro. Rol: AIO project 2013-2018. Principal investigator en co-promotor
Toelichting: van dit geld is een OIO aangesteld (Mw M. Rijkers) die in dienst van Sanquin (1,0 fte) dit onderzoek verricht" |
Bij onderwerp sialic acid en trombocytenoverleving geen trekker /betrokkenheid opstellen aanbevelingen |
|
J.L. Kerkhoffs |
Internist - Hematoloog (0,8 FTE)
|
Transfusie-specialist / transfusie research (0,2 FTE) via Sanquin
|
Op Sanquin verricht ik klinisch transfusie onderzoek wat deels gefinancieerd wordt door de industrie TerumoBCT: PI van de PREPAReS studie, een RCT naar de klinische effectiviteit van trombocyten concentraten behandeld met een pathogeen-reductie proces (Mirasol, TERUMO BCT).
|
Restricties t.a.v. producten behandeld met pathogeen reductie proces en biomarkers. Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig.
|
|
R. Schutgens |
Internist-hematoloog
|
Lid van Medische Adviesraad patiëntenvereniging ITP |
-Speakersfee (voor instituut) en/of unrestricted research grant en/of lid advisory board van: Bayer, Baxalta, CSL Behring, NovoNordisk, Sanquin, Pfizer, Bristol-Meyers Squibb -Principal Investigator van de Trombocytopathie in Nederland (TiN) studie, mede gefinancierd door een unrestricted grant van Sanquin - deelname (in UMCU) ontwikkeling PACT en U-PACT (geen financieel belang) |
Geen betrokkenheid vragen bij bloedplaatjesfunctietest (PACT). Deze onderwerpen zijn vooralsnog niet geprioriteerd voor de richtlijn, dus geen restricties nodig. |
|
M. Coppens |
Internist-vasculaire geneeskunde
|
- Diverse naschollingen en adviesraden (allen incidenteel) aangaande directe orale anticoagulantie georganiseerd door de fabrikanten van deze middelen, te weten Boehringer Ingelheim, Bayer, Pfizer, Bristol-Meyers Squibb, Daiichi Sankyo. Deze diensten zijn betaald, waarbij het geld naar mijn instituut gaat - Adviesraad aangaande 'The future of hemophilia treatment' georganiseerd door CSL Behring. Twee maal een advisory board; in 2015 en 2016. Deze diensten zijn betaald waarbij geld naar instituut gaat. CSL Behring produceert o.a. Haemocomplettan P (fibrinogeenconcentraat) en Beriplex (vierfactorenconcentraat). De huidige richtlijn zal mogelijk off-label gebruik van deze 2 middelen gaan bespreken. De genoemde adviesraad richtte zich op hemofilie A en B en de producten Haemocomplettan P en Beriplex zijn hier niet aan de orde geweest." |
Lid van de Stuurgroep van de Trombopathie in Nederland studie (geen financiele belangen). -Sanquin Blood Supply: Prothrombin Complex Concentrate (PCC) for the immediate reversal of the anticoagulant effects if new oral anticoagulants in emergency situations. Sanquin Blood Supply is producent van Cofact, een PCC, - CSL Behring: Biomarkers to detect subclinical arthropathy and predict long-term clinical arthropathy in patients with hemophilia. This project was awarded a 2016 Heimburger Award. CSL Behring produceert zowel Haemocomplettan P (fibrinogeenconcentraat) als Beriplex (een PCC), Dit project is gecofinancierd door CSL Behring, maar hebben geen betrekking op Haemocomplettan P noch Beriplex. |
Geen betrokkenheid opstellen aanbevelingen t.a.v. fibrinogeenconcrentraat en vierfactoren concentraat |
|
E. Lopriore |
Sectiehoofd Neonatologie WAKZ/LUMC |
Lid bloedtransfusiecommissie LUMC |
Onderzoek gefinancieerd door Sanquin: 1. PROC 12-012-027: Matisse studie: RCT in neonaten naar twee verschillende triggers voor trombocyten transfusies 50 vs 25; Promovenda: Suzanne Gunnink 2. PROC 16-33: Promotie onderzoek naar Rhesus hemolytische ziekt: Promovenda: Isabelle Ree |
Geen restricties |
|
H. van Ommen (meelezer) |
Kinderhematoloog |
|
'- PI Einstein junior (Bayer) Behandeling trombose bij kinderen - PI Hokusai kinderen (Daiichi Sankyo) Behandeling trombose bij kinderen - Nationaal coördinator BMS studie Apixaban ter preventie van trombose bij kinderen met een hartafwijking |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afstemming met de Patiëntenfederatie, Stichting Zeldzame Bloedziekten en Oscar Nederland. Deze verenigingen zijn uitgenodigd voor de invitational conference (knelpuntenanalyse) voorafgaand aan deze herziening en hebben input geleverd voor de te prioriteren vragen. De verenigingen hebben aangegeven graag in de commentaarfase de conceptrichtlijn te ontvangen voor commentaar. Tevens zal in de eindfase van deze richtlijn nog worden overlegd over de communicatie aan patiënten en of er nog aanvullende teksten voor patiënten kunnen worden opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan zal bij afronding van de richtlijn te vinden zijn bij de aanverwante producten. De werkgroep zal tevens de interne kwaliteitsindicatoren die bij de Richtlijn bloedtransfusie 2011 zijn opgesteld beoordelen en indien nodig door ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitters van de werkgroepen en de adviseurs de knelpunten. De werkgroepen beoordeelden de aanbevelingen uit de eerdere richtlijn Bloedtransfusiebeleid (2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen en andere aanwezigen tijdens de Invitational conference. De werkgroepen stelden vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseurs concept-uitgangsvragen opgesteld. Deze zijn in de werkgroepen besproken waarna de werkgroepleden de definitieve uitgangsvragen hebben vastgesteld. Vervolgens inventariseerden de werkgroepen per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroepen waardeerden deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroepen tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews (Medline). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje “Overwegingen”.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk om mee te wegen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en de weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn word aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroepen. Naar aanleiding van de commentaren word de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroepen. De definitieve richtlijn word aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2012.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
