Allergische reacties bijwerking biologicals
Uitgangsvraag
Hoe kunnen allergische reacties, c.q. vorming van antistoffen tegen biologicals, als bijwerking van biologicals worden voorkomen en, indien deze optreden, worden behandeld?
Aanbeveling
Ter preventie van allergische reacties (al dan niet gerelateerd aan antistofvorming) wordt aanbevolen om
- bij patiënten met RA en de ziekte van Crohn biologicals te combineren met het gebruik van een ander immunosuppressivum, zoals MTX bij RA of thiopurines bij IBD;
- bij patiënten met de ziekte van Crohn bij gebruik van infliximab te starten met 5 mg/kg in een behandelschema van 0-2-6 weken en infusies eventueel te combineren met hydrocortison;
- bij alle andere aandoeningen kunnen geen aanbevelingen geformuleerd worden wegens gebrek aan literatuur.
Bij optreden van milde lokale/infusiereacties dient de infusiesnelheid te worden verminderd.
Om herhaling van milde lokale/infusiereacties te voorkomen valt, voorafgaand aan een volgende infusie, toediening van clemastine en paracetamol te overwegen.
Bij ernstige reacties dient het infuus te worden gestopt.
Een ernstige infusiereactie dient te worden bestreden met hydrocortison, clemastine, paracetamol en op indicatie adrenaline.
Mits geen andere behandelalternatieven voorhanden zijn, valt het te overwegen om vóór aanvang van een volgend infuus een testdosis van het biological te geven.
Overwegingen
Gegevens over het optreden van allergische reacties zijn beperkt, zowel per individueel product als per specifieke indicatie (ziektebeeld). Veel data over monotherapie zijn afkomstig uit de IBD literatuur en betreffen gebruik van infliximab. Bijwerkingen en ontwikkeling van anti-infliximab antistoffen en de behandeling ervan worden in de literatuur beschreven. Aangezien infliximab een chimere antistof is, kunnen bijwerkingen van gehumaniseerde antistoffen minder zijn.
Indien milde infusiereacties optreden, kan vaak worden volstaan met het minderen van de infusiesnelheid.
Bij ernstige reacties ligt het voor de hand het middel in kwestie blijvend te staken. Pas bij ontbreken van alternatieven en ziekteactiviteit die behandeling behoeft, kan worden overwogen het middel opnieuw toe te dienen, dan evenwel nadat een testdosis zonder problemen is gegeven. De rol van antistofbepaling in de dagelijkse praktijk is, naar mening van de werkgroep, in deze onvoldoende uitgekristalliseerd om hierover een standpunt in te nemen.
Ter preventie van infusiereacties en antistofvorming wordt aanbevolen biologicals te combineren met het gebruik van een ander immunosuppressivum (hydrocortison, methotrexaat, azathioprine), vooral bij ziektebeelden waarbij andere immunosuppressiva vaak toch al worden gebruikt. Deze conclusie is gebaseerd op IBD en RA literatuur bij gebruik van infliximab. Enige terughoudendheid is derhalve op zijn plaats met het generaliseren van deze data naar andere ziektebeelden en biologicals.
Onderbouwing
Achtergrond
Patiënten met IMID worden in toenemende mate behandeld met biologicals die parenteraal (subcutaan of intraveneus) worden toegediend. Daarbij kunnen aspecifieke lokale reacties optreden die ontstaan door bijvoorbeeld een reactie op een in de infusievloeistof aanwezig middel waarmee het biological in oplossing wordt gehouden. Daarnaast kunnen lokale of systemische overgevoeligheidsreacties optreden waarbij antistoffen een rol kunnen spelen die zijn ontstaan doordat biologicals niet-lichaamseigen (deels zelfs niet-humane) componenten bevatten. Door de aanwezigheid van deze niet-lichaamseigen componenten kunnen antistoffen tegen biologicals worden gevormd die aanleiding tot afweerreacties kunnen geven. De vraag is of overgevoeligheidsreacties optreden, waar deze dan uit bestaan, hoe frequent en bij welke biological ze optreden, en hoe deze reacties zijn te voorkomenof te behandelen.
Conclusies
|
Niveau 1 |
Het gebruik van biologicals (TNFα-blokkers, anakinra, adalimub, rituximab, tocilizumab) kan gepaard gaan met lokale of systemische infusiereacties.
A1 Campi 2007 B Cohen 2004; Haggerty 2007; Emery 2006; Genovese 2008 |
|
Niveau 2 |
Lokale/infusiereacties verlopen over het algemeen mild en komen minder voor bij gelijktijdig gebruik van immunosuppressieve medicatie, zoals methotrexaat of een lage dosis glucocorticoïden.
B Kapetanovic 2006; Augustsson 2007; Emery 2006 |
|
Niveau 1 |
Bij gebruik van TNFα-blokkers, in het bijzonder bij infliximab en in mindere mate adalimumab, kan antistofvorming voorkomen. De antistofvorming is geassocieerd met een hogere kans op infusiereacties en mogelijk met een verminderde werkzaamheid. Ook gebruik van anakinra en rituximab kan antistofvorming induceren.
A1 Furst, 2008; Campi et al, 2007 B West et al, 2008; Cohen et al, 2004 C Thurlings et al 2009 |
|
Niveau 1 |
Vorming van antistoffen tegen infliximab bij RA en de ziekte van Crohn wordt minder vaak gezien tijdens gelijktijdig gebruik van immunosuppressiva (hydrocortison, methotrexaat, azathioprine).
A1 Baert et al, 2003, Vermeire et al, 2007 B Farell et al, 2003; Maini et al, 1998 |
|
Niveau 3 |
Vorming van antistoffen tegen infliximab bij de ziekte van Crohn wordt minder vaak gezien door te starten met een oplaadschema en onderhoudstherapie volgens een vast schema.
C Hanauer et al, 2004 |
|
Niveau 2 |
Bij optreden van milde infusiereacties kan vaak worden volstaan met minderen van de infusiesnelheid.
B Cheifetz et al, 2003 C Lequerre et al, 2006 |
|
Niveau 3 |
Ernstige acute infusiereacties kunnen worden bestreden door het infuus te staken, en de patiënt te behandelen met hydrocortison, clemastine, paracetamol en adrenaline.
C Cheifetz et al, 2003 |
Samenvatting literatuur
De overgevoeligheidsreacties kunnen op basis van de klinische verschijnselen worden ingedeeld als milde, matige of ernstige (infusie)reacties. De milde reacties worden gekenmerkt door temperatuursverhoging, hartkloppingen, transpireren, hoofdpijn, misselijkheid en duizeligheid. In matige reacties is sprake van hypo- of hypertensie (waarbij de systolische bloeddruk meer dan 20 mm Hg verandert), temperatuursverhoging, thoracale klachten, kortademigheid, hartkloppingen en urticaria. De ernstige reacties bestaan uit een bloeddrukverandering van meer dan 40 mm Hg, temperatuursstijging met rillingen, ernstige kortademigheid en/of stridor (Cheifetz et al, 2003).
De meeste reacties verlopen mild tot matig, maar 3-5% van de patiënten behandeld met biologicals ontwikkelen vaak een ernstige infusiereactie tijdens het inlopen van het infuus. Ook na dagen kunnen overgevoeligheidsreacties nog optreden (zie verder). De meest voorkomende overgevoeligheidsreacties/bijwerkingen worden (voor biologicals) geclassificeerd als types α en β (Pichler, 2006). Deze indeling is niet gebaseerd op klinische verschijnselen, hetgeen door de grote diversiteit van de gebruikte middelen onmogelijk is. De type α reactie wordt gekenmerkt door cytokine release, is een reactie die op basis van farmacologie verwacht kan worden, en is dosis-afhankelijk. De type β reacties kunnen op basis van farmacologische gegevens niet worden voorspeld, zijn (relatief) dosis-onafhankelijk en wordt als overgevoeligheidsreactie in engere zin geduid. De pathogenese van de type β reacties is niet duidelijk maar waarschijnlijk is deze reactie gerelateerd aan celactivatie (via Fcγ-receptoren) en/of complementactivatie via immuuncomplexformatie, aangezien deze reactie vaak wordt gezien als antistoffen tegen de biologicals aanwezig zijn (Baert et al, 2003; Han et al, 2004). Deze antistoffen zijn van de IgG klasse en de ontwikkeling hiervan is in wisselende frequentie beschreven. In een studie bij patiënten met de ziekte van Crohn, behandeld met infliximab on demand en zonder co-medicatie, werden na 5 infusies bij 68% van de patiënten antistoffen tegen infliximab aangetoond (Baert et al, 2003). De aanwezigheid van antistoffen hoeft overigens niet te leiden tot symptomen, maar kan wel aanleiding geven tot inactivatie van de biological (Bartelds et al, 2007; Thurlings et al, 2009; Wolbink et al, 2006; West et al, 2008).
Als symptomen optreden, ontstaan die vaak na 3-12 dagen ten gevolge van immuuncomplex formatie met serumziekte, vasculitis en nefritis en ze worden gekenmerkt door spierpijn, gewrichtspijn, koorts, huiduitslag, oedeem en purpura (Han et al, 2004; Pijpe et al, 2005). Ook trombocytopenie kan voorkomen (Han et al, 2004).
TNFα-blokkers
Infliximab
Infliximab is een chimere antistof, en ontwikkeling van anti-chimere antistoffen wordt frequent gerapporteerd, variërend van 8-68% (Campi et al, 2007). De aanwezigheid van anti-chimere antistoffen is mogelijk gerelateerd aan afname van werkzaamheid van infliximab en tevens met zowel acute als late infusiereacties (Wolbink et al, 2006; de Vries et al, 2007; Radstake et al, 2008). Gezien dit chimere karakter wordt in het bijzonder bij infliximab vorming van autoantilichamen gerapporteerd. Bij de overige antiTNFα medicatie is dat weinig onderzocht, maar lijkt het minder vaak te leiden tot klinische verschijnselen (Furst et al, 2008).
De acute infusiereactie treedt vaak op bij de eerste toediening en lijkt onafhankelijk van de onderliggende ziekte aangezien reacties bij diverse ziektebeelden worden gerapporteerd (Cheifetz et al, 2003; Lequerre et al, 2006; Augustsson et al, 2007; Brimhall et al, 2008). In een studie met 165 patiënten met de ziekte van Crohn traden deze reacties op bij 26 (5,3 %) van de in totaal 479 infliximab infusies (Cheifetz et al, 2003). Bij 203 RA en ankyloserende spondylitis (AS) patiënten werd in 23 gevallen (11.3 %) (Lequerre et al, 2006) een acute infusiereactie waargenomen. In een studie met alleen RA patiënten werd een reactie gerapporteerd in 28 van de 324 patiënten (8.6%) (Augustsson et al, 2007). Late infusiereacties zijn zeldzaam, en traden in de studie met 165 patiënten met Crohn bij slechts 3 patiënten op (Cheifetz et al, 2003).
Etanercept
Etanercept wordt subcutaan gegeven en kan daarbij lokale prikreacties in de vorm van roodheid, zwelling en jeuk veroorzaken. Deze reacties treden op bij 20-49% van de patiënten en verdwijnen meestal spontaan (Campi et al, 2007). Genoemde klachten treden vaak op in de eerste maand na de start van de behandeling, nemen af in de loop der tijd, en leiden derhalve zelden tot staken van de behandeling. De pathogenese van deze lokale reacties is overigens onbekend.
Antistoffen tegen etanercept worden veel minder vaak (0-6%) geconstateerd dan bij infliximab (Campi et al, 2007).
Adalimumab
Lokale reacties worden bij 12% (43/360) van de patiënten gerapporteerd. Antistofvorming treedt op, maar is minder frequent gevonden dan bij infliximab monotherapie en lijkt, althans bij IBD en RA patiënten, tot afname van de effectiviteit van de behandeling te leiden (West et al, 2008, Bartelds et al, 2007). In een open-label studie met 41 RA patiënten bleek aanwezigheid van antistoffen tegen infliximab bij start van behandeling met adalimumab niet tot afname van de effectiviteit te leiden, zodat geen kruisreactiviteit tussen anti-infliximab en anti-adalimumab antistoffen aanwezig lijkt (van der Bijl et al, 2008).
Uit de geleidelijk toenemende hoeveelheid data (bij infliximab en nu ook bij adalimumab) blijkt dat de vorming van antistoffen bij sommige biologicals gepaard kan gaan met lage dalspiegels van het desbetreffende medicament en ook met verminderde werkzaamheid. Toch is er nog geen consensus over de noodzaak tot het bepalen van antistoffen en het meten van serumspiegels in de dagelijkse praktijk. Resterende vragen gaan onder andere over de effectiviteit van andere imunosuppressieve medicatie ter preventie van antistoffen en de mogelijkheden om alsnog effectiviteit te bereiken met hogere spiegels (Wolbink, 2009). Een ander meer praktisch punt is dat bij falen van een biological na een initiele goede response stoppen met dit medicament voor de hand ligt, met of zonder antistoffen.
Andere biologicals
Ook bij andere biologicals worden lokale en acute infusiereacties alsmede de vorming van antistoffen beschreven. Gebruik van anakinra gaat bij de meerderheid van de patiënten (tot 70%) gepaard met lokale reacties op de plaats van injectie, die overigens zelden behandeling behoeft (Bresnihan et al, 2004; Fleischmann et al, 2003). Bij anakinra werd bij 2.8% van de 297 RA patiënten aanwezigheid van antistoffen geconstateerd (Cohen et al, 2004). Bij 7 van de 8 patiënten met antistoffen traden lokale injectiereacties op. Ook bij abatacept wordt bij 3% (60 van de 1990) antistofvorming gevonden (Haggerty et al, 2007).
Infusie van rituximab leidt bij ongeveer 35% van de patiënten tijdens het eerste infuus tot infusiereacties (Emery et al, 2006). Dit percentage daalt tot 10% bij het tweede infuus. In een studie bij 58 patiënten met RA werd de ontwikkeling van anti-rituximab antistoffen waargenomen bij 5 (8.6%) van de deelnemers (Thurlings et al, 2009). Bij gebruik van tocilizumab is in een studie met 802 patiënten tijdens infusie bij 1 patiënt een anafylactische reactie opgetreden en werd de studie bij een andere patiënt gestaakt in verband met een niet-bedreigende overgevoeligheidsreactie (Genovese et al, 2008). In een andere RCT wordt melding gemaakt van 9.1% infusiereacties in de 4 mg/kg tocilizumab groep, versus 9.4% in de 8 mg/kg tocilizumab groep en 6.3% in de placebogroep (Emery et al, 2008).
Preventie van lokale/ infusie-reacties en antistofvorming
Bij RA patiënten bleek het optreden van infusiereacties geassocieerd met aanwezigheid van anti-nucleaire antistoffen en afwezigheid van gelijktijdig MTX gebruik (Kapetanovic et al, 2006). Naast gelijktijdig gebruik van MTX kan een lage dosis glucocorticoiden de frequentie van transfusiereacties doen afnemen (van 8.6 naar 4.6%) (Augustsson et al, 2007). Ook bij rituximab is aangetoond dat gebruik van corticosteroïden het optreden van infusiereacties met zo’n 30% reduceert (Emery et al, 2006).
Indien zich een lichte tot milde transfusiereactie heeft voorgedaan kan, ter preventie van een reactie bij een volgend infuus, eventueel premedicatie in de vorm van clemastine en paracetamol p.o., 1,5 uur voor een volgend infuus worden gegeven. Voor aanvang van het infuus wordt vervolgens gedurende 15 minuten een testdosis infliximab (10 ml/uur) gegeven. Indien zich eerder ernstige reacties hebben voorgedaan wordt bovendien tevoren 100 mg hydrocortison i.v. toegediend. Met dit protocol werden geen recidief reacties waargenomen (Cheifetz et al, 2003). Bij RA patiënten bleek de ontwikkeling van antistoffen tegen infliximab (HACA, humane anti-chimere antistoffen) indirect gerelateerd aan de gebruikte dosering infliximab. HACA werden aangetoond bij 53%, 21% en 7% van de patiënten die respectievelijk een dosering van 1, 3, en 10 mg/kg infliximab kregen. Deze data moeten met de nodige voorzichtigheid worden geïnterpreteerd omdat het (theoretisch) mogelijk is dat bij een hogere dosering infliximab de HACA worden weggevangen. Gelijktijdig gebruik van een lage dosis MTX (7.5 mg/week) resulteerde in een verdere afname van de HACA formatie tot respectievelijk 15%, 7% en 0% in de 3 verschillende groepen ((Maini et al, 1998). Ook bij patiënten met de ziekte van Crohn werd minder HACA vorming gevonden in patiënten die gelijktijdig immunosuppressieve medicamenten (azathioprine, mercaptopurine of methotrexaat) gebruikten. Van de patiënten met immunosuppressieve medicamenten ontwikkelden 43% (24 van de 56) antistoffen in vergelijking met 75% (52 van de 69) van de patiënten zonder deze middelen (p < 0.01) (Baert et al, 2003), hetgeen in een vervolgstudie werd bevestigd (Vermeire et al, 2007). Ook premedicatie met hydrocortison verlaagt het optreden van antistofvorming bij Crohn patiënten, maar kan dat niet volledig voorkomen (Farrell et al, 2003). Bij patiënten met de ziekte van Crohn wordt in de richtlijnen bij gebruik van infliximab premedicatie met 200 mg hydrocortison en co-medicatie in de vorm van een thiopurinemetaboliet of foliumzuurantagonist aanbevolen (CBO-IBD, 2008). Daarentegen wordt gebruik van dergelijke co-medicatie bij patiënten met ankyloserende spondylitis (AS) niet aanbevolen (Richtlijn voor de diagnostiek en behandeling van Ankyloserende Spondylitis. 2009). Tenslotte wordt, bij gebruik van infliximab zowel bij IBD als AS, een inductieschema met infusie bij 0,2 en 6 weken aanbevolen, terwijl tegelijkertijd gewezen wordt op een voortgaande onderhoudstherapie met infliximab teneinde het interval tussen toedieningen niet te verlengen (zoals bij on demand behandeling) omdat dit ook geassocieerd is met meer infuusreacties. Dit regime gaf bij Crohn patiënten minder antistofvorming dan een regime waarbij een enkele infusie werd gegeven (Hanauer et al, 2004).
Behandeling van lokale/ infusie-reacties
Uit een studie bij Crohn patiënten behandeld met infliximab blijkt dat bij de meeste patiënten verlaging van de infusiesnelheid volstaat. Bij ernstige reacties kan adrenaline worden gegeven (0.1-0.5 ml, 1:1000, sc) maximaal 2 keer te herhalen met 5 minuten interval, met 100 mg hydrocortison iv, gevolgd door clemastine 2 mg i.v. en paracetamol 1000 mg (Cheifetz et al, 2003).
Ook in een studie bij RA en AS patiënten blijkt dat bij een acute infusiereactie terugschroeven van de infusiesnelheid bij de meeste patiënten voldoende is om de symptomen te bestrijden (Lequerre et al, 2006).
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-01-2011
Laatst geautoriseerd : 01-01-2011
Geplande herbeoordeling : 01-01-2014
De Nederlandse Vereniging voor Reumatologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. Uiterlijk in 2013 bepaalt de NVR of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De andere aan deze richtlijn deelnemende beroepsverenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid ten aanzien van het bewaken van de actualiteit van de aanbevelingen in de richtlijn. Hen wordt verzocht relevante ontwikkelingen binnen hun vakgebied kenbaar te maken aan de eerstverantwoordelijke.
Algemene gegevens
Met ondersteuning van de afdeling Ondersteuning Professionele Kwaliteit van de Orde van Medisch Specialisten. De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (= SKMS).
Doel en doelgroep
Deze richtlijn geeft een leidraad voor de dagelijkse praktijk van het gebruik van Biologicals. De richtlijn heeft een algemeen karakter, kan gebruikt worden om beroepsspecifieke richtlijnen te formuleren en biedt aanknopingspunten voor bijvoorbeeld lokale (instituuts- of regiogebonden) protocollen en/of zorgafspraken.
De richtlijn is primair geschreven voor medisch specialisten die patiënten met chronische ontstekingsziekten (IMID = Immune Mediated Inflammatory Disorders) behandelen met biologicals, alsmede voor deze patiënten zelf en hun overige behandelaars.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2009 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die met biologicals te maken hebben.
Bij het samenstellen van de werkgroep is rekening gehouden met geografische spreiding en evenredige vertegenwoordiging van verschillende verenigingen, ‘scholen’ en academische achtergrond. De werkgroepleden zijn door de wetenschappelijke verenigingen gemandateerd voor deelname en de samenstelling van de werkgroep is goedgekeurd door alle deelnemende wetenschappelijke verenigingen. De werkgroepleden zijn gezamenlijk verantwoordelijk voor de tekst.
- Dr. D.L. Baeten, reumatoloog, Academisch Medisch Centrum, Amsterdam
- Dr. M. Bijl, reumatoloog, Universitair Medisch Centrum Groningen
- Prof. dr. J.W.J. Bijlsma, reumatoloog, Universitair Medisch Centrum Utrecht (voorzitter)
- Dr. A.A. van Bodegraven, maag-, darm-, leverarts, VU Medisch Centrum, Amsterdam
- Dr. P.L.A. van Daele, internist-klinisch immunoloog, Erasmus Medisch Centrum, Rotterdam
- Prof. dr. M. Drent, longarts, Academisch Ziekenhuis Maastricht
- Mevr. drs. G.J. Geven, Reumapatiëntenbond, Amersfoort
- Mevr. drs. J.W. Hagemeijer, senior adviseur, Orde van medisch Specialisten, Utrecht
- Dr. T.L.Th.A. Jansen, reumatoloog, Medisch Centrum Leeuwarden
- Prof. dr. M.A.F.J. van de Laar, reumatoloog, Medisch Spectrum Twente, Enschede
- Prof. dr. R.B.M. Landewé, reumatoloog, Academisch Ziekenhuis Maastricht
- Prof. dr. W.F. Lems, reumatoloog, VU medisch centrum, Amsterdam
- Dr. M.T. Nurmohamed, reumatoloog, Jan van Breemen Instituut, Amsterdam
- Dr. E. Prens, dermatoloog, Erasmus Medisch Centrum, Rotterdam
- Mevr. drs. M.M.J.H. Scholte-Voshaar, Reumapatiëntenbond, Amersfoort
- Mevr. drs. M. Wessels, informatiespecialist, Orde van Medisch Specialisten, Utrecht
Belangenverklaringen
De werkgroepleden is gevraagd om aan te geven of er sprake is van een mogelijke belangenverstrengeling met commerciële bedrijven. Een overzicht hiervan is hieronder weergegeven. De verklaringen van werkgroepleden over mogelijke financiële belangenverstrengeling ligt ter inzage bij de afdeling Ondersteuning Professionele Kwaliteit van de Orde van Medisch Specialisten. Uit de ingevulde belangenverklaringen blijkt dat de werkgroepleden banden met de farmaceutische industrie hebben en dat deze banden gezien het onderwerp belangrijk zijn. Er wordt geconcludeerd dat deze banden geen invloed hebben gehad bij het totstandkomen van de richtlijn.
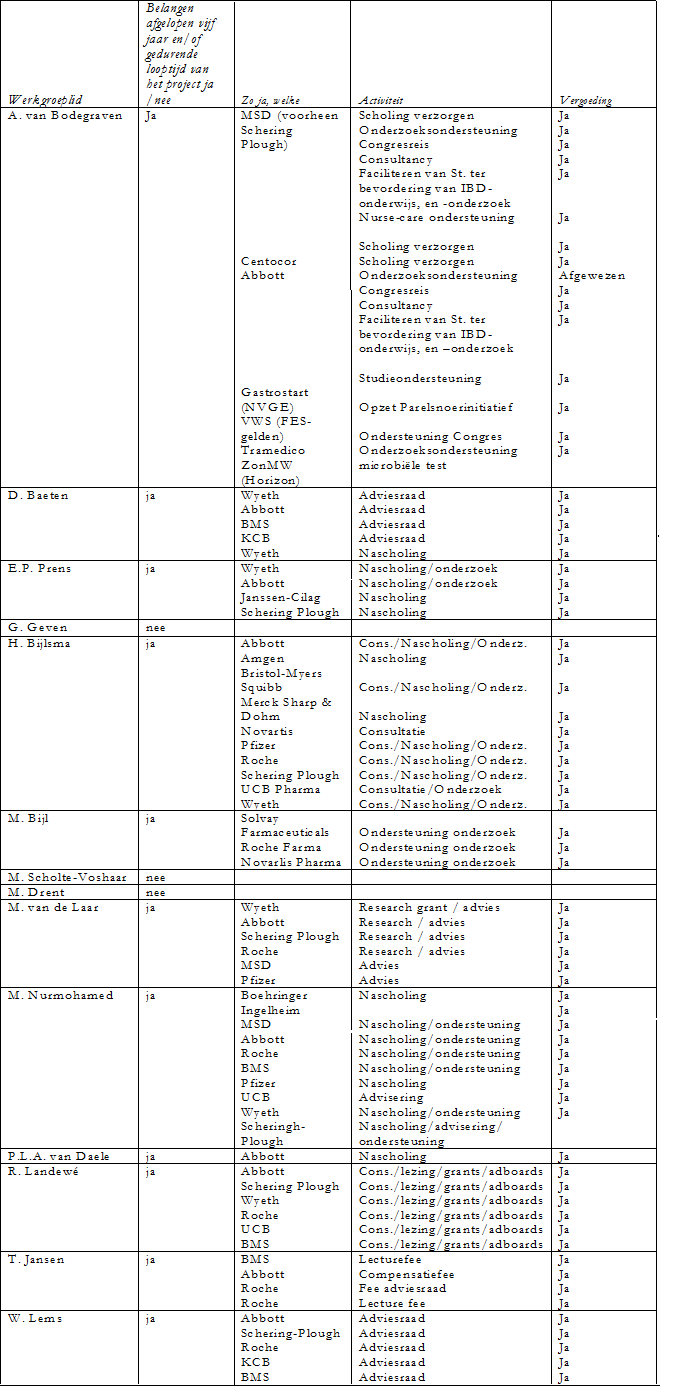
Inbreng patiëntenperspectief
Gedurende de ontwikkeling van de richtlijn is nadrukkelijk aandacht besteed aan het in kaart brengen van het patiëntenperspectief. In de werkgroep hebben twee patiëntenvertegenwoordigers zitting genomen en zij brachten het perspectief van de patiënten naar voren tijdens de bespreking van de teksten en de formulering van de aanbevelingen. Daarnaast is halverwege het traject een focusgroep georganiseerd waaraan 9 patiënten hebben deelgenomen. De uitgangsvragen zijn voorgelegd aan de leden van de focusgroep en hen is gevraagd naar hun ervaringen en overwegingen die zij van belang achten bij het formuleren van de aanbevelingen. Hiervan is een verslag gemaakt en aan de leden voorgelegd ter verifiëring en eventuele aanvulling. De leden van het schrijverscollectief hebben gebruikgemaakt van de inhoud van deze documentatie voor de formulering van overwegingen vanuit patiëntenperspectief. Een verslag hiervan is hieronder te vinden.
Patiëntenperspectief – verslag focusgroep
In totaal hebben 9 patiënten hun medewerking verleend aan het in kaart brengen van het patiëntenperspectief. Twee mannelijke patiënten met Sarcoidose met Remicade (via infuuskliniek (1 X p.m.) of Humira zelf injecteren (1X p.w.), één mannelijke patiënt met Psoriasis Enbrel zelf injecteren (1X p.w.), twee vrouwen met RA (Enbrel en Rituximab), één mannelijke patiënt met RA (Enbrel), twee vrouwelijke patiënten met Ziekte van Crohn (Humira en Remicade).
Drie personen waren aanwezig bij de focusgroepbijeenkomst die gehouden is op 12 november 2009. De overige 5 personen waren niet in staat om aanwezig te zijn en hebben op digitale wijze hun input geleverd door per uitgangsvraag hun ervaringen terug te koppelen.
Naast het bespreken van de ervaringen is ook gevraagd naar overwegingen die vanuit het perspectief van de patiënt van belang zijn en die naar hun idee meegewogen dienen te worden bij de formulering van de aanbevelingen.
Uit de besprekingen is naar voren gekomen dat de patiënten de geformuleerde uitgangsvragen complex vinden. De patiënten hebben aangegeven dat het maken van een patiëntenversie van de richtlijn belangrijk is omdat nog veel onduidelijk is over het gebruik van biologicals. Door het ontwikkelen van een patiëntenversie van de richtlijn ontvangen de patiënten een instrument waarmee zij ook kunnen bijdragen aan het goed en verantwoord gebruik van biologicals. Hierbij is als voorwaarde gesteld dat de patiëntenversie toegankelijk geschreven moet worden.
Alle deelnemers waren lid van een patiëntenvereniging en ervaren dit als zeer plezierig. Het geeft onder meer de mogelijkheid tot het uitwisselen van informatie met lotgenoten.
VOORAFGAANDE AAN DE BEHANDELING MET BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 1: - Patiënten geven aan dat de aanloop naar de behandeling met biologicals overwegend een langdurig proces is geweest. Er wordt overgegaan tot biologicals als alle andere behandelingsvormen niet blijken te helpen of te veel bijwerkingen veroorzaken. - Patiënten vinden het belangrijk dat alle aspecten die van belang zijn bij de behandeling van biologicals worden onderzocht, maar hebben geen zicht op welke aspecten dit dan moeten zijn. Zij geven aan dat het echter belangrijk is dat zij door de specialist of door de verpleegkundige deelgenoot worden gemaakt van het afwegingsproces door informatie te ontvangen zodat zij zelf actief kunnen meewerken aan het zorgproces. |
Overweging vanuit het patiëntenperspectief bij UV 2: - Patiënten vinden het belangrijk dat de arts door wie zij worden behandeld deskundig is, zodat zij erop kunnen vertrouwen in goede handen te zijn. - De (voorschrijvende) medisch specialist dient de regie in handen te houden en daarbij is het overleg met de andere betrokken professionals belangrijk. - Het is belangrijk dat de professionals communicatief zijn en duidelijk uitleg kunnen geven op niveau van de leek. Daarnaast is het wenselijk dat de medisch specialist toegankelijk en laagdrempelig is bij vragen; te weten via de telefoon of email. - Als het niet goed gaat met de patiёnt is het belangrijk dat de medisch specialist confronterend en direct is door aan te geven dat het helemaal niet goed gaat, dat de patiënt zich overvraagt of dat bijvoorbeeld gestopt moet worden met werken. Het is daarbij belangrijk dat de patiënt geen ruimte wordt gegeven om te marchanderen. - De partner is samen met de patiënt ziek en hiermee een essentiёle schakel die duidelijk betrokken behoort te worden in het zorgproces. |
BIJWERKINGEN VAN BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 3: - Patiënten vinden het belangrijk dat zij duidelijke en volledige (zowel schriftelijke als mondelinge) informatie ontvangen over de bijwerkingen die zich kunnen voordoen bij een behandeling met biologicals. - Patiënten vinden het belangrijk dat, als zij bijwerkingen ervaren, duidelijk is tot wie zij zich moeten richten, dus tot de huisarts of de medisch specialist. - Patiënten vinden het belangrijk dat, als zij bijwerkingen ervaren, hier serieus naar wordt gekeken en deskundig op wordt geacteerd. - Patiënten vinden het belangrijk dat zij instructies ontvangen wat zij zelf kunnen doen om bepaalde bijwerkingen te voorkomen. |
Overweging vanuit het patiëntenperspectief bij UV 4: - Patiënten vinden het belangrijk dat zij informatie ontvangen over de het risico op kanker bij biologicals. - Patiënten vinden het belangrijk dat zij actief worden gevolgd op het mogelijk ontstaan van kanker. |
ZWANGERSCHAP EN BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 5: Op basis van de focusgroep zijn geen overwegingen aan te dragen. |
BIOLOGICALS EN (OPERATIEVE) INGREPEN: |
Overweging vanuit het patiëntenperspectief bij UV 6: - Patiënten vinden het belangrijk dat de voorschrijvend specialist betrokken is bij het besluitvormingsproces van een operatie. Daarbij is het essentieel dat er direct contact is tussen de betrokken specialisten. - Patiënten vinden het belangrijk dat zij in bezit zijn van een ‘kaartje’ waarop staat dat zij biologicals gebruiken en dat met de specialist contact opgenomen moet worden in geval van tandheelkundige of operatieve ingrepen. - Patiënten vinden het belangrijk dat zij informatie ontvangen over de stappen die gezet moeten worden bij het staken of doorgaan van biologicals bij een operatie. Hierdoor zijn zij in staat zelf actief mee te werken en hebben meer het gevoel controle te hebben over hun behandeling met biologicals. |
FOLLOW-UP VAN DE BEHANDELING MET BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 7: - Patiënten vinden het belangrijk dat zij regelmatig (om de 3 tot 6 mnd) door de medisch specialist worden onderzocht waarbij de werking van de biologicals in kaart wordt gebracht. - Patiënten vinden het belangrijk dat zij worden geinformeerd over de uitslag van de periodieke controle zodat zij deelgenoot zijn van het zorgproces. - Patiënten geven aan geconfronteerd te worden met een veelheid aan informatiestromen die regelmatig tegenstrijdig zijn. Zij vinden het belangrijk dat hier meer regie over gevoerd gaat worden. - Patiënten vinden het belangrijk dat professionels aangeven wanneer men geen duidelijkheid ten aanzien van bepaalde vraagstukken kunnen geven omdat nog zoveel onbekend is bij de behandeling van biologicals. - Patiënten vinden het belangrijk regelmatig contact te hebben met de (specialistisch) verpleegkundige zodat zij eventuele vragen kan beantwoorden. |
BIOLOGICALS EN VACCINATIE: |
Overweging vanuit het patiëntenperspectief bij UV 8: - Patiënten vinden het belangrijk dat zij (tijdig) informatie ontvangen over welke vaccinaties zij toegediend kunnen krijgen. - Patiënten vinden het belangrijk dat zij informatie ontvangen bij welke verschijnselen, nadat zij een vaccinatie hebben ontvangen, zij contact op moeten nemen met de medisch speicalist. |
DE BEHANDELING MET BIOLOGICALS: |
Overweging vanuit het patiëntenperspectief bij UV 9: - Patiënten vinden het belangrijk dat de arts door wie zij worden behandeld deskundig is en over de meest recente inzichten beschikt zodat zij erop kunnen vertrouwen in goede handen te zijn. - De (voorschrijvende) medisch specialist dient de regie in handen te houden en daarbij is het overleg met de andere betrokken professionals belangrijk. - Het is belangrijk dat de professionals communicatief zijn en duidelijk uitleg kunnen geven op niveau van de leek. Daarnaast is het wenselijk dat de medisch specialist toegankelijk en laagdrempelig is bij vragen; te weten via de telefoon of email. - Als het niet goed gaat met de patiёnt is het belangrijk dat de medisch specialist confronterend en direct is door aan te geven dat het helemaal niet goed gaat, dat de patient zich overvraagt of dat bijvoorbeeld gestopt moet worden met werken. Het is daarbij belangrijk dat de patiënt geen ruimte wordt gegeven om te marchanderen. |
LANGDURIG VERBLIJF ELDERS: |
Overweging vanuit het patiëntenperspectief bij UV 10: - Patiënten vinden het belangrijk dat zij informatie ontvangen over: - hoe zij de biologicals het beste naar het buitenland kunnen vervoeren; - naar welke gebieden zij kunnen reizen; - de mogelijkheden om in het buitenland een infuus met biologicals te ontvangen.
|
Methode ontwikkeling
Evidence based
Implementatie
Tijdens de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de uitvoerbaarheid van de aanbevelingen. Daarbij is gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn is verspreid onder alle relevante beroepsgroepen en instellingen. Een samenvatting van de richtlijn is gepubliceerd in het Nederlands Tijdschrift voor Geneeskunde en in tijdschriften van de deelnemende wetenschappelijke verenigingen.
Werkwijze
De werkgroep heeft een jaar aan de totstandkoming van de richtlijn gewerkt. Binnen de werkgroep was een schrijverscollectief ingesteld. De leden van het schrijverscollectief zochten systematisch naar literatuur en beoordeelden kwaliteit en inhoud ervan. Vervolgens schreven zij een concepttekst waarin de literatuur werd verwerkt. Tijdens vergaderingen lichtten zij hun teksten toe aan de overige leden van de werkgroep. De conceptrichtlijn is in februari 2010 schriftelijk aan alle betrokken wetenschappelijke verenigingen aangeboden en gevraagd de richtlijn aan hun leden voor te leggen. Daarnaast is de richtlijn ook naar wetenschappelijke verenigingen gestuurd die niet in de werkgroep hebben geparticipeerd, te weten oogartsen, neurologen, gynaecologen en tandartsen. De ontvangen commentaren zijn, waar relevant bevonden, verwerkt in de definitieve richtlijn.
Wetenschappelijke onderbouwing
De onderbouwing van de richtlijn is mede gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Relevante artikelen werden gezocht met systematische zoekacties. Er werd gezocht tussen 1998 en 2009 in Medline en Embase. Voor de oriënterende search werd ook gezocht in de Cochrane Library en werd specifiek gezocht naar al bestaande richtlijnen in online raadpleegbare (inter)nationale guideline clearinghouses.
Hierbij werd de taal gelimiteerd tot Nederlands, Engels, Duits en Frans. Daarnaast werden artikelen geëxtraheerd uit referentielijsten van opgevraagde literatuur. Dit leverde bij enkele uitgangsvragen nog aanvullende artikelen op.
Doordat de uitgangsvragen niet gericht waren op het beoordelen van de effectiviteit van de interventies maar veelal gingen over bijwerkingen, complicaties en diagnostiek bleek een beperking tot systematische reviews en RCTs vaak niet zinvol. De searches zijn verricht in mei en juni 2009. Voor alle uitgangsvragen is gebruik gemaakt van een uniforme formulering van de patiëntencategorie en de interventie.
Voor de gehanteerde zoektermen wordt verwezen naar Appendix 1. Op verzoek zijn de volledige zoekstrategieën beschikbaar. Daarnaast werden artikelen geëxtraheerd uit referentielijsten van opgevraagde literatuur en zijn enkele relevante publicaties tot 1 november 2009 meegenomen. Lopend onderzoek is buiten beschouwing gelaten. Abstracts van congressen van de afgelopen 2 jaar (november 2007 tot 1 november 2009) zijn meegenomen bij de selectie van de literatuur. Relevante informatie vanuit deze abstract wordt uitgewerkt bij de overige overwegingen. Onder samenvatting van de literatuur / conclusies worden alleen gepubliceerde onderzoeken / richtlijnen uitgewerkt.
De geselecteerde artikelen zijn beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijs. Hierbij is de standaardindeling gebruikt: zie tabel 1. Na selectie bleven de artikelen over die als onderbouwing bij de verschillende conclusies staan vermeld. De beoordeling van de verschillende artikelen is opgenomen onder het kopje ‘samenvatting van de literatuur’. Het wetenschappelijk bewijs is vervolgens kort samengevat in een ‘conclusie’. De belangrijkste literatuur waarop deze conclusie is gebaseerd staat bij de conclusie vermeld, inclusief de mate van bewijs (zie tabel 2).
Voor het formuleren van een aanbeveling zijn, naast het wetenschappelijk bewijs, vaak nog andere aspecten van belang, bijvoorbeeld patiëntenvoorkeuren, kosten, beschikbaarheid of organisatorische aspecten. Deze aspecten worden, voor zover niet wetenschappelijk onderzocht, vermeld onder het kopje ‘overwegingen’. In de overige overwegingen spelen de ervaring en de mening van de werkgroepleden een belangrijke rol. De ‘aanbeveling’ is het resultaat van de combinatie van het beschikbare bewijs en de overige overwegingen.
Voor een aantal uitgangsvragen zijn evidencetabellen gemaakt en deze zijn te raadplegen in Appendix 3.
Tabel 1: Indeling van methodologische kwaliteit van individuele studies
|
|
Interventie |
Diagnostische accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
A1 |
Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controleonderzoek, cohort-onderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohortonderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohortonderzoek of patiënt-controleonderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Tabel 2: Niveau van bewijs van de conclusie
|
Conclusie gebaseerd op |
|
|
1 |
Onderzoek van niveau A1 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
2 |
Eén onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
Eén onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Deze (concept)richtlijn is opgesteld aan de hand van het Appraisal of Guidelines for Research & Evaluation (AGREE) instrument. Dit instrument is in een Europees verband opgesteld om de procedurele kwaliteit van richtlijnen te kunnen beoordelen. Door de aspecten van AGREE te verwerken in de inleiding van de richtlijn, wordt duidelijk aan welke kwaliteitseisen is voldaan.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
