Antibioticaprofylaxe bij gewrichtsprothese
Uitgangsvraag
Is antibioticaprofylaxe geïndiceerd bij patiënten met een gewrichtsprothese die een tandheelkundige ingreep ondergaan?
Aanbeveling
- Het is niet geïndiceerd om antibiotische profylaxe te geven aan patiënten met een gewrichtsprothese vóór een mond- of tandheelkundige ingreep ter preventie van een hematogene infectie van de gewrichtsprothese.
- Evenmin geldt dat in geval van verminderde immuniteit van de patiënt.
- Het is aanbevelingswaardig om bij de patiënt het belang van een goede mondgezondheid te benadrukken en regelmatige tandheelkundige controles aan te raden.
Overwegingen
Voor een advies over antibioticaprofylaxe in gewrichtsprothesepatiënten is vanwege de zeer lage bewijskracht in de geïncludeerde literatuur vervolgens in de niet geïncludeerde literatuur gezocht naar informatie die nog verder inzicht zouden kunnen bieden in de pathofysiologie en in risico factoren en risico ingrepen. Bestudeerd zijn ook reviews, richtlijnen en diverse landelijke adviezen. Daarbij is met name een antwoord gezocht voor de volgende vragen:
1.Wat betreft bacteriëmie:
- Hoeveel bacteriën zijn in de circulatie nodig om een hematogene infectie te veroorzaken van een gewrichtsprothese?
- Wat zijn de kenmerken van bacteriemiën in mensen qua soort bacterie, aantal en duur?
2. Wat betreft de leeftijd van de gewrichtsprothese (joint age):
- Is er in de periode van de eerste 2 jaar inderdaad een verhoogd risico op hematogene infectie, zoals gesuggereerd in vooral Amerikaanse literatuur?
3. Wat betreft bloedverlies bij tandheelkundige ingrepen:
- Is er bij bloedverlies (“bleeding”) bij tandheelkundige en mondhygiënische ingrepen een verhoogd risico?
- Zo ja: is het dan nodig antibiotica profylactisch te geven?
- Zo ja: wat is de consequentie voor de regelmatig uit te voeren mondhygiënische ingrepen, of de zelf uit te voeren mondzorg?
4.Wat betreft verminderde immuniteit:
- Wanneer is er sprake van verminderde immuniteit, c.q. afweer voor bacteriële infecties?
- Is er dan een verhoogd risico op hematogene PJI?
- Is er een dan reden om wèl antibiotica profylaxe te geven?
- Als ja: bij welke ingrepen?
- Als ja: welk antibioticum, welke dosis, op welk moment?
5. Wat zijn de bijwerkingen van antibiotica in relatie tot de mogelijke effectiviteit (risk/benefit)?
6. Wat zijn de kosten in relatie tot de effectiviteit (costs/effectivity)?
7. Wat moet geadviseerd worden in geval van plaatsing van een gewrichtsprothese aan preoperatieve en postoperatieve controle en zorg voor de dentitie?:
- Moet elke patiënt vòòr de gewrichtsprothese plaatsing het gebit laten screenen en saneren?
- Is een advies noodzakelijk voor postoperatieve mondhygiënische ingrepen of controles?
8. Is een desinfecterende mondspoeling vóór of tijdens tandheelkundige zorg aangewezen bij patiënten met een gewrichtsprothese?
1 Bacteriëmie
Omdat hematogene PJI’s weinig voorkomen, worden vaak bacteriemiën beschouwd als een surrogaat uitkomst om het risico op hematogene PJI te bepalen (Watters, 2013). Naast een antwoord op de vraag of een bacteriëmie wel een PJI kán veroorzaken, is ook een antwoord nodig op de volgende vragen: wat is de incidentie van de bacteriemiën bij mensen, om welke bacteriën gaat het, hoe hoog is na ingrepen de concentratie van bacteriën in de bloedbaan in kolonievormende eenheden (KVE) per milliliter (ml), en hoe lang duurt zo’n bacteriëmie?
Dat een implantaat hematogeen kan infecteren is in enkele dierstudies aangetoond. Bij een knieprothese in het konijn was driemaal een injectie intraveneus nodig met 1,2 tot 7,2 x 109 KVE Staphylococcus aureus of 1x108 KVE Proprionibacterium acnes. De injectie met S. aureus leidde in de eerste dagen na de implantatie tot 70% infecties en bij besmetting op zeven weken tot 35% (Blomgren, 1981). Een kophalsprothese in de heup bij het konijn werd hematogeen besmet direct postoperatief of drie weken na implantatie. De 50% infectie dosis was 104 KVE S. aureus, respectievelijk 3,8 x 104 KVE (Southwood, 1985). Maar bij de groep die drie weken postoperatief werd geïnfecteerd was de mortaliteit hoog: 10/30 konijnen.
Een subcutaan gelegen teflon implantaat bij de cavia werd geïnfecteerd via intracardiale injectie met S. aureus. Infectie trad pas op bij injectie met 5 maal 107 KVE, die resulteerde in een bacteriëmie van 100-1000 KVE/ml na vijf minuten en slechts tot 11/26 implantaat infecties (Zimmerli, 1985).
In het konijn kon een intramedullair titanium pen geïnfecteerd worden via intra-arteriële besmetting met 5 x 108 KVE S. aureus (Vogely, 2000; Poultsides, 2008).
Tabel 1: Dierexperimenten waarbij via hematogene weg een implantaat infectie is veroorzaakt
|
1ste auteur |
jaar |
implantaat |
dier soort |
bacterie |
toedienings-weg |
interval sinds implantatie en inoculatie dosis |
|
Blomgren |
1981 |
knieprothese |
konijn |
S. aureus |
intraven. |
1e wk: 2-5 x (3,6 x 109) |
|
S. aureus |
intraven. |
7e wk: 1-3 x (1,2 x 109) |
||||
|
Southwood |
1985 |
heup kophalsproth. |
konijn |
S. aureus |
intraven. |
0 wk: 1 x 104 |
|
3 wk: 3,8 x 104 |
||||||
|
Zimmerli |
1981 |
teflon implantaat |
cavia |
S. aureus |
intra-card. |
4 wk: 5 x 107 |
|
Poultsides |
2008 |
i.m. titanium pen |
konijn |
S. aureus |
intra-art. |
4 wk: > 3 x 108 |
|
Vogely |
2000 |
i.m. titanium pen |
konijn |
S. aureus |
intra-art. |
4 wk: 5 x 108 |
Een gewrichtsprothese kan dus inderdaad via een bacteriëmie in het diermodel geïnfecteerd worden. De benodigde doses zijn echter erg hoog en vaak ontstaat sepsis. Deze hoge doses komen bij patiënten nauwelijks voor, in ieder geval niet na ingrepen in de mond of elders in het lichaam.
Op basis van zijn dierexperimenten en recente klinische data, geeft Zimmerli aan dat een bacteriëmie bij patiënten alleen relevant is indien die hoger is dan 1000 KVE/ml. Dat komt alleen voor bij sepsis (Zimmerli, 2013). Na een S. aureus sepsis vond Murdoch inderdaad in 34% (15/44) een hematogeen veroorzaakte infectie van gewrichtsprothesen en overigens in 7% (1/15) hematogeen geïnfecteerd osteosynthese materiaal (Murdoch, 2001).
De soort bacteriën die PJI veroorzaken zijn meestal S. aureus en coagulase negatieve staphylococcen (ieder circa in 30%) (Uçkay et al. 2008, Schrama et al. 2012, Parvizi et al. 2013). Als bacterie die potentieel afkomstig is uit de mondholte worden beschouwd: beta hemolytische streptococcen, Peptostreptococcus species, Actinomyces species en viridans streptococcen
Deze bacteriën uit de mondholte zijn ongeveer in 10% de veroorzaker van een PJI (Ainscow, 1984; Waldman, 1997; Berbari, 2010b; Zimmerli, 2010). Er zijn echter toenemend aanwijzingen dat S. aureus en S. epidermidis vaker dan gedacht ook in de mondholte voorkomen: bij kinderen, ouderen, diabeten en ernstig zieken (Friedlander, 2010; Olsen; 2010) en dus ook de veroorzaker kunnen zijn van hematogene PJI. Ze zouden 0,005% van de orale flora uitmaken (Rossi, 2005). Berbari vond in zijn case-control studie in geval van S. aureus PJI, geen verhoogd risico op hematogene infectie na mondheelkundige ingreep (Berbari, 2010a).
De incidentie van bacteriemiën bij mensen in het dagelijks leven is groot: bijvoorbeeld bij kauwen 8 tot 51%, bij flossen 20 tot 58% (Kotzé, 2009) (zie tabel 2). Na tandheelkundige ingrepen is er een wisselende incidentie (American Academy of Orthopaedic Surgeons, 2012; Watters, 2013). Er is een mediane incidentie van 5% voor kauwen en 65% voor eenvoudige tandextractie en gingivectomie, met overigens bijzonder grote spreidingen (American Academy of Orthopaedic Surgeons, 2012; Watters, 2013).
Tabel 2: Bacteriemiën bij diverse dagelijkse handelingen of tandheelkundige of scopische ingrepen naar: (Deacon et al. 1996, Lockhart 1996, Tomás et al. 2007, Abraham-Inpijn 2009, Kotzé 2009, Ugwumba et al. 2014)
|
Dagelijks leven |
|
|
Diverse ingrepen |
|
|
Flossen |
20 tot 58% |
|
Oesophagusdilatatie |
31% |
|
Kauwen |
8 tot 51% |
|
Cystoscopie |
19% |
|
Tandenstokers |
20 tot 86% |
|
Sclerotherapie oesofagusvarices |
18% |
|
Tandenpoetsen handmatig |
16 tot 68% |
|
ERCP |
11% |
|
Tandenpoetsen sonicare |
33 tot 78% |
|
Sigmoïdoscopie |
5% |
|
|
|
|
Endoscopie prox. Tr.Dig. |
4% |
|
Tandheelkundige ingrepen |
|
|
Colonoscopie |
4% |
|
Extracties |
51 tot 100% |
|
Transoesofageaal echocardiogram |
2% |
|
Intraligamentaire anesthesie |
97% |
|
|
|
|
Paradontale chirurgie |
36 tot 88% |
|
|
|
|
Scalen en rootplanen |
8 tot 88% |
|
|
|
|
Endodontie |
0 tot 54% |
|
|
|
|
Matrixbandjes en wiggen aanbrengen |
32% |
|
|
|
|
Rubberdam aanbrengen |
30% |
|
|
|
|
Polijsten |
24% |
|
|
|
De duur van een bacteriëmie was na poetsen of een tandextractie in een groep van 296 patiënten bijna steeds korter dan 20 minuten en de concentratie was steeds minder dan de bepalingsgrens van 104 KVE/ml (Lockhart, 2008).
De cumulatieve expositie aan bacteriemiën gedurende een maand werd berekend door Guntheroth ten gevolge van kauwen, tandenpoetsen, mondinfecties en uiteindelijke een tandextractie. Hij vond dat die expositie 5376 minuten bedroeg waarvan slechts zes minuten ten gevolge van de tandextractie (Guntheroth, 1984). Roberts berekende dat de dagelijkse cumulatieve expositie ten gevolge van baseline bacteriëmie ruim vijf miljoen maal groter was dan na een in de literatuur steeds als meest riskant geachte kiesextractie. Een eenvoudig gebitsonderzoek leidde tot 48 maal grotere kans op bacteriëmie, tandpolijsten 390 maal en intraligamentaire anesthesie ruim 53000 maal (Roberts, 1999).
Sommige tandheelkundige ingrepen worden in de literatuur als invasief bestempeld, waarbij het risico op bacteriëmie vergroot wordt geacht en daarom eventueel een indicatie voor antibioticaprofylaxe zouden kunnen vormen. Een mogelijke indeling zou die van Berbari kunnen zijn, waarbij als tandheelkundige ingreep met laag risico wordt beschouwd: restoratieve ingreep, vullen van tand of kies, endodontische ingreep en fluoride applicaties, en als hoog risico ingreep: mondhygiënische behandeling, chirurgische ingrepen in de mond, periodontale ingrepen, extracties en abcesingrepen (Berbari, 2010b) (zie ook overweging 5).
Antibiotica zijn volgens sommige auteurs in staat de incidentie en de duur van een bacteriëmie na een tandheelkundige ingreep te verminderen. Young vond dat Amoxicilline één uur voor een tandheelkundige ingreep het risico op bacteriëmie verminderde met ongeveer 63% (26,7 tot 73%) (Young, 2014). De cumulatieve incidentie van bacteriëmie was in een gerandomiseerde trial met drie groepen (tandenpoetsen en tandextracties met wél dan wel zónder antibioticaprofylaxe) respectievelijk 23, 33 en 60%. Het geven van antibioticaprofylaxe bij een tandextractie, veroorzaakte significant lagere incidentie van bacteriëmie tot en met 40 minuten na de extractie (Lockhart, 2008).
In een gerandomiseerde trial bij 100 kinderen verminderden antibiotica de incidentie van bacteriëmie na operatieve uitgebreide mondzorg significant, maar konden bacteriëmie niet helemaal voorkomen. De meeste bacteriëmie werd overigens bij gingivitis gevonden (Brennan, 2007).
De resultaten uit de literatuur zijn echter niet consistent. In een kleine RCT met 30 patiënten werd geen significante reductie gevonden door antibioticaprofylaxe voorafgaand aan een tandextractie in de incidentie of omvang van bacteriëmie ten opzichte van Chloorhexidine-mondspoeling of placebo (DuVall, 2013). Ook Scott, vond geen effect van AB-profylaxe op de incidentie en hoogte van de bacteriëmie (Scott, 2005).
Conclusie
|
|
Bacteriemiën komen veel voor bij tandheelkundige ingrepen, maar zijn ook in het normale dagelijkse leven frequent, echter kortdurend. De invloed van antibiotica op bacteriëmie is onzeker. |
2 Gewrichtsprothese leeftijd
In de eerste AAOS-richtlijnen werd steeds het risico voor een gewrichtsprothese om hematogeen geïnfecteerd te raken het grootst geacht te zijn in de eerste twee jaar na de implantatie. Die termijn heeft daarna op veel plaatsen ingang gevonden (Colterjohn, 2014). De onderbouwing is echter maar beperkt en is terug te voeren naar een artikel van Hanssen (1996) waarin echter wordt verwezen naar een tweetal niet gepubliceerde voordrachten van Osmon in 1993 voor de Musculo Skeletal Infection Society (MSIS). Zij vonden dat in de eerste twee jaar na implantatie de frequentie het grootst was: een frequentie van 0,14 per 100 prothesejaren (BI 0,07 tot 0,25) en >2 jaar: 0,03 (BI 0,01 tot 0,07). Evenals in de dierexperimenten werd het verschil geweten aan de voor de weke delen benodigde tijd voor genezing, wat echter veel te lang lijkt. De periode van twee jaar lijkt wel te worden ondersteund door de gegevens die Deacon verzamelde in de literatuur. Alle PJI die verondersteld werden hematogeen veroorzaakt te zijn en 50% van 144 infecties traden op in de eerste twee jaar na implantatie (Deacon, 1996).
Hamilton (2008) volgden 30 jaar prospectief ruim 2000 totale heupprothesen. een infectie ontstond bij 29 (1,5%) heupprothesen. Het infectiepercentage steeg van 0,9% op twee jaar postoperatief naar 2,0% op 20 jaar na de implantatie. Vijf van de 29 infecties waren (17,2%) mogelijk ontstaan door hematogene oorzaak: vier daarvan >2 jaar na implantatie (Hamilton, 2008).
Uçkay, (2009) volgde prospectief een cohort van 6101 electieve THP en TKP gedurende een mean follow-up van 70 maanden. De patiënten maakten 553 infecties elders in het lichaam door. Er traden 71 PJI op (0,9%): 21 “early” (<3 maanden postop), 24 “delayed” en 26 “late” (>2 jaar postop). Van zeven hematogene infecties (7/6101=0,1%) waren twee delayed en vijf laat (Uçkay, 2009). In dit cohort kon dus evenmin bevestigd worden dat de periode van <2 jaar een verhoogd risico bestaat.
In een cohort van 112.708 heup- en knieprothesen, met 619.299 prothesejaren uit het Fins Arthroplasty Register werden de late (>2 jaar) en zeer late (>5 jaar) infecties getraceerd met behulp van een koppeling aan een nationaal ziekenhuis ontslagregister. De incidentie van late, waarschijnlijk hematogene PJI varieerde in deze studie van 0,041% tot 0,107% per jaar, met de laatste jaren mogelijk enige toename bij de zeer late infecties (Huotari, 2015). Berbari vond bij de patiënten met een PJI geen frequenter voorkomen van hoog of laag risico tandheelkundige ingrepen in de 6 of 24 maanden voorafgaand aan de opname voor de PJI (Berbari, 2010b; American Academy of Orthopaedic Surgeons, 2012).
In analogie met de dierexperimenten lijkt een postoperatieve periode van verhoogd risico die veel korter is, in de orde van weken, waarschijnlijker dan een periode van enkele jaren. Het is echter onbekend wat het aandeel van hematogene oorsprong is in de vroege postoperatieve infecties.
Het is dus mogelijk dat in de eerste postoperatieve weken na implantatie een gewrichtsprothese gevoeliger is voor hematogene infectie, maar onwaarschijnlijk dat die periode tot twee jaar aanhoudt. Overigens blijkt in dierexperiment dat antibioticum houdend botcement in de eerste paar weken postoperatief waarschijnlijk een goede bescherming geeft tegen deze hematogene infecties (Elson, 1977; Blomgren, 1981). Bij in vitro studies is dit beschermend effect, gelokaliseerd in de 'interfacial gap' grenzend aan het botcement, vooral aanwezig in de eerste uren tot dagen na implantatie van de gewrichtsprothese en na ongeveer drie weken grotendeels verdwenen (Hendriks, 2005).
In de meeste studies over PJI wordt aangenomen dat juist de late infecties, waarvoor in het algemeen de periode >2 jaar postoperatief wordt aangehouden, hematogeen zijn. Dat lijkt verklaarbaar doordat met het toenemen van het aantal jaren postoperatief meer low grade peroperatief veroorzaakte infecties (SSI) al manifest geworden zijn en vooral hematogene infecties resteren. Een goede indruk geeft dan het “zeer late” infectiepercentage, zoals in de Finse studie. Een enkele studie houdt zes maanden aan voor de waarschijnlijke grens tussen SSI en hematogene PJI, wat gezien het bestaan van delayed low grade infecties niet erg verhelderend is.
Conclusie
|
|
Het is onvoldoende aangetoond dat er in de eerste twee jaar na implantatie van een gewrichtsprothese een verhoogd risico bestaat op een hematogene infectie ten opzichte van de periode daarna. Hematogene infecties komen mogelijk zelfs vaker voor >2 jaar na implantatie. Een verhoogde gevoeligheid zou wel, net als in dierexperimenten, kunnen voorkomen gedurende een veel kortere periode van bijvoorbeeld enkele weken, maar dat is bij mensen niet zeker. |
3 Bloedverlies
Bacteriëmie is sinds jaren gekoppeld aan het optreden van zichtbaar bloedverlies (“bleeding”), met name sinds de American Heart Association een overigens niet onderbouwd verband legde met een verhoogd risico op endocarditis (Dajani, 1997; Dinsbach, 2012). Het lijkt er echter op dat de meeste auteurs net zoals bij de gewrichtsprothese leeftijd het optreden van bloedverlies te gemakkelijk als risicofactor overnemen. De literatuur is echter niet eenduidig. Lockhart vond dat gegeneraliseerd bloedverlies bij tandenpoetsen een bijna achtmaal groter risico op bacteriëmie opleverde, vooral bij een hogere plaque- en tandsteenscore (>2) (Lockhart, 2009).
Bij bepaalde tandmanipulaties, maar ook bij het kauwen, kunnen afwisselend negatieve en positieve drukken ontstaan wat mogelijk tot bacteriëmie zou kunnen leiden (Roberts, 1999). Roberts vond echter geen relatie tussen “bleeding” en het voorkomen van bacteriëmie. Het is waarschijnlijk dat de positieve bloeddruk die in capillairen bestaat juist verhindert dat bacteriën in de bloedbaan komen. Mogelijk is een lymfogene route de weg waarop bacteriën in de circulatie geraken, vooral bij spieractiviteit als kauwen (Guntheroth, 1984). Dit zou ook kunnen passen bij de bevindingen dat met name een weke deleninfectie aan hetzelfde been een verhoogde risicofactor voor hematogene, dan wel lymfogene PJI vormt (Ainscow, 1984; Kaandorp, 1997).
Conclusie
|
|
Er zijn onvoldoende aanwijzingen dat het ontstaan van zichtbaar bloedverlies rondom het gebit leidt tot meer bacteriëmie. |
4 Verminderde immuniteit
Bij een patiënt met een verminderde immuniteit zou een bacteriëmie gemakkelijker een infectie kunnen veroorzaken in een lagere dosis en bij een kortere duur (Seymour, 2003; Uçkay, 2009; Olsen, 2010). Een verminderde immuniteit zou aanwezig zijn bij patiënten met diabetes mellitus type 1 en 2, reumatoïde artritis (RA), hemofilie en bij ingreep met immunosuppressieve therapie. Er is echter maar weinig goed bewijs in de literatuur dat de vrees voor meer hematogene infecties bij verminderde immuniteit onderbouwt (Seymour, 2003). Immunosuppressieve therapie kan orale ulceraties veroorzaken die een porte d’entrée voor bacteriën naar de bloedbaan vormen. Daarbij is het van belang dat in de mond ook S. aureus voorkomt, vooral bij diabeten, bij acute infecties in de mondholte en bij S. aureus neusdragers (Olsen, 2010). In reumatoïde en psoriasis artritis zouden bacteriën zich in achtergebleven synoviaal weefsel van de grote gewrichten gemakkelijk kunnen nestelen en tot een infectie leiden (Olsen, 2010). Dat zou passen bij de verhoogde kans op hematogene infectie die in verschillende studies vooral bij RA werd gevonden (Ainscow, 1984; Kaandorp, 1997).
Een wat meer concrete en kwantificeerbare maat voor verminderde immuniteit zou een te laag aantal neutrofiele granulocyten kunnen zijn (Seymour, 2003). In de Zweedse richtlijn wordt daarvoor arbitrair aangehouden <1,0 x 109 /L (Zweedse richtlijn, 2012; Stephánsdóttir, 2014).
In de case-control studie die aan de basis ligt van de AAOS-richtlijn uit 2012, vond Berbari geen verhoogd risico voor PJI in geval van verminderd geachte immuniteit (met name diabetes mellitus) bij van tandheelkundige ingrepen, voor hoog-risico ingrepen noch voor laag-risico ingrepen (Berbari, 2010b).
Bij een ernstige granulopenie kan een bacteriëmie ook op andere plaatsen in het lichaam dan gewrichtsprothesen tot infecties leiden. Een antibioticaprofylaxe bij tandheelkundige ingrepen zou vanwege dit risico bij granulopenie geïndiceerd kunnen zijn, maar dan in verband met deze risico’s van de granulopenie en niet voor bescherming van de prothese. De indicatie voor een dergelijke profylaxe zou gesteld moeten worden door de beroepsgroepen die deze patiënten behandelen, bijvoorbeeld infectiologen en oncologen.
Conclusie
|
|
Het is onduidelijk hoe de relatie is tussen een verlaagde immuniteit voor bacteriële infecties en de kans op een hematogeen veroorzaakte PJI. Er is geen bewijs dat er bij verlaagde immuniteit sprake is van een verhoogd risico op hematogene PJI. Incidentie, cumulatieve duur en dosis van bacteriemiën zijn in het dagelijks leven net als bij patiënten met normale immuunstatus veel groter dan bij tandheelkundige ingrepen: tandheelkundige ingrepen vormen ook bij degenen met verminderde immuunstatus een geringer risico dan de normale, dagelijkse activiteiten. |
5 Risk / benefit
Bij het formuleren van evidence based aanbevelingen is een risk/benefit-analyse van belang. Voorwaarden voor goede analyse is dat de correcte getallen van de verschillende variabelen beschikbaar zijn. Helaas zijn voor veel van de benodigde data alleen ruwe schattingen voorhanden. Getallen over de incidentie van tandheelkundig veroorzaakte PJI, over de AB-profylaxe effectiviteit en van antibioticum bijwerkingen zijn vaak erg uiteenlopend en van lage kwaliteit.
Met de beschikbare data is het op het ogenblik dus niet goed mogelijk om een accurate risk/benefit-analyse uit te voeren voor de Nederlandse situatie. Er is daarom gekozen om middels enkele aannames een schatting te maken van de marges in de risks en benefits.
Situatieschets Nederland
De Landelijke Registratie Orthopedische Implantaten (LROI) vermeldt dat er in het jaar 2013 25.642 primaire totale heupprothesen en 23.738 primaire knieprothesen werden geplaatst. Dit komt neer op in het totaal 49.380 primaire totale heup- en primaire knieprothesen. Dit betreft een 96% registratie van het aantal geplaatsten primaire totale heup- en primaire knieprothesen. Sinds de aanvang van deze landelijke registratie in 2007 zijn er ruim 400.000 heup, knie, schouder, enkel en ellenboog vervangende operaties geregistreerd (Nederlandse Orthopaedische Vereniging, 2013; Steenbergen, 2015). Otten berekende in een trendprojectie voor 2030 een toenemende stijging van het aantal THP en TKP tot respectievelijk 51.680 en 57.893 (Otten, 2010). Over de prevalentie van patiënten met gewrichtsprothesen in Nederland zijn geen duidelijke cijfers beschikbaar. Tussen 2010 en 2014 ontvingen 132.016 patiënten een primaire heupprothese en 103.537 patiënten een primaire knieprothese. Het gaat hierbij dus om aantallen patiënten en niet om prothese aantallen en er is rekening gehouden met patiënten die een dubbelzijdige protheseplaatsing van hetzelfde gewricht ondergingen, maar er is geen correctie toegepast voor patiënten die heup- én knieprothesen kregen. Het totaal komt neer op 235.553 primaire knie- en heupprothesen. Sinds 2014 worden ook overige gewrichtsprotheseplaatsingen (e.g. schouder, ellenboog en enkel) geregistreerd. Deze worden niet meegenomen in de berekeningen in verband met de korte registratieduur en de kleine aantallen per jaar. Om een inschatting te maken van de periode vóór 2010 werd de jaarlijkse stijging van het aantal protheseplaatsingen in de jaren 2010 en 2011 geëxtrapoleerd naar de periode 1990 tot 2009. Hiermee komt het totale aantal primaire knie- en heupprotheseplaatsingen op 600.000 tot 800.000 (Steenbergen, 2015). Op het moment dat in Nederland bij een patiënt een heup- of knieprothese wordt geplaatst is die tussen 40 en 90 jaar oud, met een piek in de leeftijdsverdeling bij 70 jaar.
Leeftijdsverdeling van de patiënten bij plaatsing in 2013 van 22.183 THP. Bij 18.355 TKP is deze verdeling geheel vergelijkbaar (Nederlandse Orthopaedische Vereniging 2013).
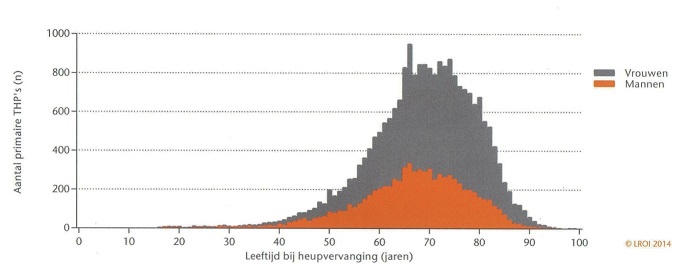
De gemiddelde levensverwachting is op het ogenblik in Nederland ongeveer 80 jaar: bij vrouwen 82,8 jaar en bij mannen 79,1 jaar. Gezien de leeftijd bij plaatsing en de levensverwachting, gebruiken patiënten in Nederland hun heup- of knieprothese dus gemiddeld tien jaar. De best mogelijke schatting van de prevalentie van patiënten met een gewrichtsprothese in Nederland komt daarmee uit op een aantal tussen 400.000 en 800.000 patiënten. Ondanks dat de hiermee berekende prevalenties voor Nederland van 2,4% tot 4,7% redelijk overeenkomen met de internationale literatuur (Lockhart, 1996; Kurtz, 2005; Swedish Hip Arthroplasty Register, 2013; Swedish Knee Arthroplasty Register, 2014), blijkt dat het niet mogelijk is betere cijfers te verkrijgen dan met deze grove schatting. Betere cijfers zijn niet voorhanden. Gezien deze onzekerheid over de prevalentie van knie- en heupprothesen zou men zich kunnen beperken tot het uitvoeren van de risk/benefit-analyse voor alleen het patiënten cohort van 2013: in totaal 49.380 primaire totale heup- en primaire knieprothesen, met een overlevingsduur van de patiënten na de prothese-implantatie van tien jaar.
Tandheelkundige ingrepen
Van de mensen ouder dan 65 jaar in Nederland ging 53,3% in 2009 regelmatig naar de tandarts en gemiddeld 2,9 keer. Dit betreft patiënten met zowel een eigen dentitie als met een gebitsprothese en er wordt geen onderscheid gemaakt tussen patiënten met of zonder gewrichtsprothese. In deze populatie >65 jaar lijkt sprake te zijn van een jaarlijkse toename in het aantal mensen dat de tandarts bezoekt (2000 tot 2009: 40,3% tot 53,3%) (Centraal Bureau voor Statistiek, 2015). Of deze trend zich voortzet tot 2015 is echter onduidelijk. De populatie van 65 jaar of ouder wordt representatief geacht voor de Nederlandse populatie met gewrichtsprothesen.
De vraag is welke van de uitgevoerde ingrepen als invasief kunnen worden aangemerkt, omdat daarbij het risico op bacteriëmie groter zou zijn en eventueel een indicatie voor antibioticaprofylaxe. Alhoewel invasiviteit vaak gelijk geschakeld wordt met het optreden van bloedverlies (bleeding), is het bloedverlies op zich geen indicatie voor bacteriëmie (zie overweging 1).
Als tandheelkundige ingreep met laag risico kunnen worden beschouwd: restauratieve ingreep, vullen van tand of kies, endodontische ingreep en fluoride applicaties. Als hoog risico ingreep: mondhygiënische ingreep, chirurgische ingrepen in de mond: parodontale ingrepen, extracties en abces ingreep (Berbari, 2010b).
In de bovengenoemde patiëntenpopulatie van 65 jaar of ouder, die contact hadden met de tandarts, werden in 2009 de volgende ingrepen uitgevoerd: trekken van tand of kies (7,4%), tandsteenverwijdering (25,4%), vullen van een caviteit (14,4%), vervaardigen van kroon of brug (8,9%), gebitsregulatie (5,9%) en fluorapplicatie (0,4%), “niet gedefinieerde overige” (37,6%) (Centraal Bureau voor Statistiek, 2015). Als hoog risico ingrepen kunnen volgens de indeling van Berbari worden beschouwd: extracties, tandsteenverwijdering en de helft van de “niet gedefinieerde overige” ingrepen. Samen vormen die in 2009 circa 50% van de tandheelkundige ingrepen. In deze 50% van de tandheelkundige ingrepen zou antibioticaprofylaxe dan eventueel geïndiceerd kunnen zijn.
Kans op PJI
Momenteel zijn er geen cijfers beschikbaar over de incidentie van tandheelkundige PJI in Nederland. Ten behoeve van deze risico analyse zal er een op de literatuur gebaseerde onder- en bovengrens worden aangehouden van 0,05 tot 0,1%. (Jacobsen, 1980; LaPorte, 1999; Cook, 2007).
De gevolgen van bacteriële artritis in de algemene bevolking zijn ernstig. In 25 tot 50% van de gevallen is er sprake van gewrichtsfunctieverlies en de mortaliteit varieert tussen de 1 tot 15% (Gillespie, 1990; Jacobson, 1991; Krijnen, 2001).
Antibioticaprofylaxe
De huidige aanbeveling ten aanzien van AB-profylaxe bij alle ingrepen (inclusief tandheelkundige) met een verhoogd risico op hematogene infectie is Amoxicilline/clavulaanzuur 500/125mg, 2 tabletten 1 uur preoperatief (Nederlandse Orthopaedische Vereniging, 2010; Swierstra, 2011). Wij zullen ons in de risk/benefit en kosten/effectiviteit analyse beperken tot dit antibioticum.
Uit meerdere onderzoeken blijkt dat antibioticaprofylaxe de incidentie van bacteriëmie na tandheelkundige ingrepen kan verlagen. Gebaseerd op een meta-analyse van 21 studies concludeert de AAOS+ADA in 2012 dat er sterke evidence is dat AB-profylaxe de incidentie van tandheelkundige bacteriëmie vermindert. Ook het soort bacterie, de duur en hoogte van de serum bacterie concentratie zouden volgens sommigen gunstig kunnen worden beïnvloed door antibioticaprofylaxe. De literatuur is er echter niet eenduidig over hoe groot het effect is en of een reductie van de bacteriëmie echt wel het geval is (Scott, 2005; Brennan, 2007; Lockhart, 2008; DuVall, 2013; Young, 2014) (zie overweging 1).
In de literatuur wordt bij effectiviteit studies vooral gebruik gemaakt van schattingen gebaseerd op endocarditis preventie. Tsevat gebruikt bij zijn berekeningen een schatting van de effectiviteit van antibioticaprofylaxe bij endocarditis, waar in de literatuur een expert panel de effectiviteit van penicilline op 90% en van erythromycine op 75% bepaalde (Tsevat, 1989). Het wordt door hem niet aangegeven waarom de effectiviteit voor preventie van PJI hetzelfde zou zijn. Ook Krijnen gebruikt voor zijn berekeningen van kosteneffectiviteit de schattingen uit endocarditis literatuur: de effectiviteit van 90% (45 tot 100%) (Krijnen, 2001).
Bij de schatting van effectiviteit gebaseerd op basis van bacteriëmie incidentie is overigens van belang dat slechts een surrogaat marker wordt gebruikt voor het ontstaan van PJI en dat een zeker klinisch wetenschappelijk bewijs voor de relatie bacteriëmie en PJI ontbreekt (American Academy of Orthopaedic Surgeons, 2012; Watters, 2013).
Het blijkt dus dat in de literatuur onvoldoende gegevens beschikbaar zijn om zelfs een behoorlijk schatting over de effectiviteit van antibioticaprofylaxe te maken. En daarmee ook niet of de door de werkgroep klinisch relevant geachte risico reductie van 50% mogelijk is. In de hierop volgende poging tot berekenen wordt een effectiviteit van 0 en 50% getoetst.
Risico’s antibiotica profylaxe
Nadelige gevolgen van penicillinegebruik omvatten onder andere milde bijwerkingen zoals: maag- darmstoornissen (tot 60%), huiduitslag, jeuk en urticaria (0,1 tot 1%) (Legout, 2012) (Zorginstituut Nederland). Allergische reacties komen anamnestisch in circa 8% van de bevolking voor. Minder dan 10% hiervan blijkt na diagnostische testen daadwerkelijk allergisch (Rijnders, 1999; Macy, 2014; NICE, 2014). Het is echter onduidelijk of de cijfers voor milde en lichte bijwerkingen ook gelden voor een éénmalige dosering.
De incidentie van ernstige bijwerkingen zoals anafylaxie varieert in de literatuur tussen 0,005 tot 0,04%, waarvan ongeveer 10% fataal (Gillespie, 1990; Jacobson, 1991; Krijnen, 2001; Scott, 2005; Legout, 2012). Thornhill gaf in een recente studie aan dat de incidentie van fatale anafylactische reacties mogelijk nog lager ligt, te weten 0 op 3 miljoen AB-voorschrijvingen en 23 niet fatale anafylactische reacties (Thornhill, 2015). Deze anafylaxie reactie kan ook optreden bij toediening van één dosis.
Naast bovengenoemde bijwerkingen vertonen penicillinen ook interacties met geneesmiddelen. Zo versterkt Amoxicilline het effect van vitamine K-antagonisten en vermindert het de renale klaring van methotrexaat (Zorginstituut Nederland, 2015a).
Daarnaast heeft onnodig en overmatig gebruik van antibiotica de afgelopen decennia geleid tot een toenemende bacteriële resistentie. In een recent gepubliceerde surveillance concludeert de European Centre for Disease Prevention and Control (ECDC) dat antibioticaresistentie een serieuze bedreiging is voor de volksgezondheid (European Centre for Disease Prevention and Control (ECDC) 2014). Verkeerd gebruik van antibiotica leidt tot verhoogde ziektekosten, verlengde opnameduur, falen van ingrepen en zelfs overlijden (SWAB, 2012), vandaar dat een restrictief gebruik van antibiotica hoge prioriteit heeft.
Analyse
Bij de uitvoering van de risk/benefit-analyse zijn de volgende aannames gedaan op basis van bovenstaande literatuur, hierbij wordt aangenomen dat de incidentie van bacteriëmie representatief is voor het ontstaan van PJI (surrogaatmarker):
- Het aantal primaire knie- of heupprotheseplaatsingen in 2013 betreft 49.380;
- De overlevingsduur van een patiënt na plaatsing is tien jaar;
- 53,3% van deze populatie ging regelmatig naar de tandarts (gemiddeld 2,9 x per jaar) naar de tandarts waarvan 50% een ingreep ondergaat die eventueel AB-profylaxe zouden behoeven. Dit betekent dat er in tien jaar circa 380.000 AB-recepten worden voorgeschreven (49.380 x 10 x [53,3% x 2,9 x 50%] = 381.633);
- De incidentie (lifetime) van hematogene PJI met een tandheelkundige ingreep als oorzaak varieert tussen 0,05 tot 0,1%;
- Voor het cohort van 2013 komt dit neer op 15 tot 49 tandheelkundige PJI gedurende tien jaar;
- Er is een mortaliteit van 10% bij PJI;
- Voor deze berekening nemen wij een effect van 50% reductie in de bacteriëmie incidentie als klinisch relevant en nemen aan dat eenzelfde reductie optreedt in de hematogeen veroorzaakte PJI incidentie;
- Allergische reactie op penicilline treedt anamnestisch in 8% van de gevallen op, een anafylactische reactie in 0,005 tot 0,04%, en van deze anafylactische reacties is 10% fataal. Voor het cohort van 2013 zijn dat circa 10 tot 80 anafylactische reacties, die in 1 tot 8 van de gevallen fataal zijn.
In bovenstaande berekeningen is met name de effectiviteit van AB-profylaxe op het voorkomen van bacteriëmie doorslaggevend. Het gaat daarbij om de relatieve reductie van bacteriëmie als surrogaatmarker, maar het is onbekend wat het effect vervolgens precies is op de preventie van PJI.
De effectiviteit van AB-profylaxe op PJI zal meer neigen naar de 0% dan naar de 50%, vooral gezien het ontbreken in de literatuur van bewijs voor effectiviteit. Alleen bij een irreële overschatting van AB-effectiviteit en een onderschatting van de bijwerkingen zouden de voordelen van AB-profylaxe op kunnen wegen tegen de nadelen. Bij deze berekeningen worden echter onzekere schattingen vermenigvuldigd met al even onzekere andere schattingen, met als gevolg een nog onzekerder uitkomst.
In bovenstaande poging tot risk/benefitanalyse zijn de risico’s van bijwerkingen, interacties en resistentie door antibioticaprofylaxe nog niet betrokken, evenmin de extramurale consequenties hiervan. Dit vormen argumenten tegen het altijd voorschrijven van antibioticaprofylaxe.
Conclusie
|
|
Het uitvoeren van een voldoende betrouwbare risk/benefitanalyse is niet mogelijk door het ontbreken van voldoende exacte cijfers in de literatuur. |
6 Kosten / effectiviteit
In de literatuur zijn er door de jaren heen verschillende kosteneffectiviteitsanalyses uitgevoerd voor verschillende patiënten populaties, AB (antibiotica)-profylaxeregimes en PJI ingrepen.
Lockhart berekende voor de Amerikaanse situatie een prevalentie van 5.959.427 mensen met een gewrichtsprothese (heup of knie). Jaarlijks zou dit leiden tot 3.000.000 circa 12.000.000 profylactische AB-kuren met variërende kosten tussen $12.008.245 tot $48.032.982 (Lockhart, 2013). Hieruit werd geconcludeerd dat de individuele kosten voor AB-profylaxe weliswaar laag zijn, maar de potentiële kosten voor de Amerikaanse zorgsector aanzienlijk. In 1989 berekende Tsevat voor een erythromycine-, penicilline- en geen AB-profylaxeregime de kosten van AB-profylaxe, anafylaxie en PJI per persoon (Tsevat, 1989). Voor penicilline kwamen deze kosten neer op respectievelijk $3.71, $0,24, en $0,15. Net als enkele andere auteurs concluderen ze dat penicillineprofylaxe duurder en minder effectief is dan geen profylaxe (Tsevat, 1989; Jacobson, 1991; Deacon, 1996). De aanwezigheid van een evidente orale infectie zou ook een rol kunnen spelen bij de kosteneffectiviteit. Bij afwezigheid van een evidente orale infectie zijn de kosten $1.500.000 per 100.000 ingrepen met AB-profylaxe vs. $1.400.000 zonder AB-profylaxe. Indien er echter wel een evidente orale infectie aanwezig is verschuift deze balans naar $1.500.000 met AB-profylaxe vs. $24.500.000 zonder AB-profylaxe ten gevolge van de verhoogde kans op PJI. Hierbij wordt uitgegaan van ~100% effectiviteit van AB en $35.000 per prothese revisie (Gillespie, 1990). Ook de kosten op basis van één number needed to treat (NNT) worden besproken in de literatuur en komen mogelijk neer op $480,000 per jaar om één dentogene PJI te voorkomen (Legout, 2012). Slover concludeerde dat AB-profylaxe alleen kosteneffectief zijn indien de kans op een PJI door tandheelkundige ingreep 1,2% is (Slover, 2014), maar dit betreft een irreële overschatting.
Bovenstaande gegevens kunnen echter niet zondermeer worden geëxtrapoleerd naar de Nederlandse situatie in verband met de mogelijke verschillen in voorgestelde AB-beleid en incidentie tandheelkundige PJI. Krijnen concludeerde op basis van een prospectieve Nederlandse kosteneffectiviteitsanalyse bij patiënten met gewrichtsafwijkingen, dat profylaxe niet is geïndiceerd bij invasieve ingrepen ter preventie van artritis. De effectiviteit van profylaxe was zeer klein en de kosten per QALY zeer hoog. Bij lagere kans op artritis dan 0,0078% waren de nadelen van antibioticaprofylaxe groter (Kaandorp, 1999). De relevantie van de studie is echter moeilijk te duiden, omdat de bestudeerde patiënten met hematogene gewrichtsinfecties maar in 25 van de 126 een gewrichtsprothese hadden (Kaandorp, 1997).
Kostenonderzoek voor de Nederlandse situatie:
Net als bij de risk/benefit-analyse zijn er voor veel van de benodigde data alleen ruwe schattingen voorhanden. Getallen over de incidentie van tandheelkundig veroorzaakte PJI, over de AB-profylaxe-effectiviteit en kosten van gewrichtsprotheserevisie zijn vaak erg uiteenlopend en van lage kwaliteit.
Met de beschikbare data is het op het ogenblik dus niet goed mogelijk om een accurate kosteneffectiviteitsanalyse uit te voeren voor de Nederlandse situatie. Er is daarom gekozen om middels enkele aannames een schatting te maken van de mogelijke kosten in de Nederlandse situatie.
Kostenonderzoek kent verschillende reikwijdtes. In deze module blijft het kostenonderzoek beperkt tot een globale kostenbepaling van de directe kosten die binnen de gezondheidszorg worden gemaakt. Dit omvat de kosten die gemaakt worden tijdens de preventie van PJI en de klinische ingreep van PJI (e.g. diagnostiek, therapie en ziekenhuisopname). Het in de overweging meenemen van de maatschappelijke perspectieven, lange termijn gevolgen en (in)directe kosten buiten de zorg gaat te ver voor deze analyse. Onderstaande berekeningen zijn wederom gebaseerd op het huidige beleid van Augmentin® 1250mg p.o., 1 uur preoperatief (Nederlandse Orthopaedische Vereniging, 2010; Swierstra, 2011).
Ten behoeve van dit kostenonderzoek, voor het patiënten cohort van 2013, worden eerdere aannames aangevuld met de volgende aannames:
- De kosten Augmentin® 1250mg zijn gemiddeld: €0,78 (Zorginstituut Nederland, 2015b);
- Vergoeding ter handstelling per recept: €5,99 (College voor zorgverzekeringen, 2010);
- De kosten van ingreep anafylactische reactie met ziekenhuisopname tot maximaal 5 dagen €1.130,- (DBC onderhoud, 2015);
- De kosten van een operatieve ingreep van een geïnfecteerde gewrichtsprothese (knie of heup) zijn gemiddeld: €14.230,- (DBC onderhoud, 2015).
Deze kosten omvatten zowel debridement met behoud van de prothese, als 1-stage of 2-stage extractie-revisies. Deze getallen komen overeen met tarieven, zoals in diverse ziekenhuizen berekend zijn: circa €10.000,- (prothese in situ ingreep) tot € 30.000,- (extractie, re-implantatie in 2-stage) bij een geschatte verhouding voor deze ingrepen van circa in 75% in situ ingreep en in 25% extractie van de gewrichtsprothese.
Net als bij de risk/benefitanalyse geldt ook voor de kosten/effectiviteitberekening dat er veel onzekerheden bestaan over de benodigde getallen. Allereerst is de werkelijke effectiviteit van antibiotica in de preventie van tandheelkundige PJI onduidelijk en voornamelijk gebaseerd op de preventie van de surrogaatmarker bacteriëmie en niet van de hematogene PJI’s. Er is daarnaast niet voldoende inzicht in de extramurale behandelkosten en de kosten veroorzaakt door invaliditeit. Ook hier geldt dat het vermenigvuldigen van onzekere schattingen met al even onzekere andere schattingen zal leiden tot niet realistische uitkomsten met grote marges.
Conclusie
|
|
De uitvoering van een kosteneffectiviteitsanalyse is gezien de onzekerheid over, of zelfs vaak het ontbreken van, voldoende exacte cijfers in de literatuur niet mogelijk. |
7 Mondhygiëne en gebitsscreening
Dagelijkse activiteiten zoals kauwen, tandenpoetsen en interdentaal reinigen kunnen leiden tot een bacteriëmie. Bij orale aandoeningen zoals tandplaque, gingivitis en parodontitis is er sprake van een veranderde samenstelling van het orale microbioom en mogelijk een verhoogde bacterial load ten opzichte van de gezonde situatie. Daarnaast ondergaat het parodontium ten tijde van gingivitis en parodontitis enkele histologische verandergingen (e.g. toegenomen vascularisatie en verhoogde permeabiliteit van sulcusepitheel) die er mogelijk toe leiden dat de orale bacteriën gemakkelijker in de bloedbaan terecht kunnen komen. Deze factoren leiden tot de vraag of bovenstaande orale aandoeningen een verhoogde kans geven op het ontstaan van een bacteriëmie, en uiteindelijk of eventuele behandeling van de aandoeningen leidt tot een verminderde kans op tandheelkundige hematogene PJI.
Tomás verrichtte in 2012 een systematisch review met deze vraag (Tomás, 2012). Hierbij werd er alleen gekeken naar dagelijkse mondzorg, zoals poetsen en flossen. Na literatuurscreening werden 12 van de 290 artikelen geïncludeerd. Op basis van een meta-analyse van zeven artikelen concludeerde hij dat zowel een verhoogde plaquescore als gingivitis een verhoogde kans op bacteriëmie gaven na tandenpoetsen. De gepoolde odds ratio’s waren respectievelijk 2.61 (95%CI = 1,45 tot 4,69) en 2.77 (95%CI = 1,50 tot 5,11). Geen van de geïncludeerde artikelen vond echter een significante toename in bacteriëmie na flossen of kauwen. Ook andere onderzoeken vonden dat de aanwezigheid van gingivitis of parodontitis tot een hogere incidentie bacteriëmie leidt na dagelijkse mondzorg of tandheelkundige ingreep zoals scalen en het vullen van caviteiten (Forner, 2006; Brennan, 2007; Raber-Durlacher, 2013). Lockhart vond echter geen invloed van de mondhygiënestatus op de bacteriëmie incidentie na een tandextractie (Lockhart, 2009). Het direct vergelijken van deze onderzoeken is moeilijk in verband met de variatie in meetmethoden, diagnostische criteria, ingrepen en patiënten populaties.
Er is een groeiend inzicht dat er een relatie is tussen algemene gezondheid en mondgezondheid (Olsen 2015, Zaura et al. 2015). Het belang van een goede mondgezondheid zowel voor als na gewrichtsprotheseplaatsing wordt door verschillende auteurs benadrukt (Bartzokas, 1994; Lockhart, 1996; Seymour, 2003; Forner, 2006, v Montfort, 2013). Het is momenteel geen routine om patiënten waarbij een THP of TKP geplaatst zal worden, voorafgaand aan de operatie te screenen op tandheelkundige infectieuze foci. Er is weinig gepubliceerd over de effectiviteit van een preoperatieve tandheelkundige screening in de preventie van PJI. Gezien de lage incidentie van tandheelkundige PJI is het methodologische moeilijk om dit goed te onderzoeken. Om een beeld te krijgen van de dentale status van patiënten die een THP en TKP zouden ontvangen, verrichtte Barrington et al. een prospectieve studie in een cohort van 100 patiënten (Barrington et al, 2011). Hieruit bleek dat 23% van de patiënten onbehandelde cariës had. Bij deze 23 patiënten werden 32 elementen gevuld, 26 geëxtraheerd, één wortelkanaalingreep uitgevoerd en zes kronen geplaatst. Eén patiënt moest wegens parodontitis worden verwezen naar de parodontoloog voor scaling/rootplaning. Geen van deze patiënten kreeg een infectie gedurende de eerste 90 dagen na de operatie. Deze korte postoperatieve periode is overigens veel meer de periode van vroeg postoperatieve infecties en niet zozeer van hematogene infecties. Er kan dus weinig geconcludeerd worden over de effectiviteit van de tandheelkundige ingrepen ten aanzien van PJI preventie, ook al omdat hematogene infecties vooral later postoperatief manifest worden (Huotari, 2015).
Om een aanbeveling te kunnen doen die aangeeft dat gestreefd moet worden naar een goede mondgezondheid vóór en ná een gewrichtsprotheseplaatsing zijn bruikbare definities van een gezonde mond nodig, en kennis van hoe mondgezondheidszorg invloed heeft op bacteriëmieën. Pas nadat er aan de hand van klinische parameters (onder andere parodontitis-score, cariës-index, bloedingsindex, maar ook samenstelling microbioom) definities geformuleerd zijn, is het mogelijk om op basis van de literatuur aanbevelingen te doen.
Daarnaast geldt echter dat, alhoewel een direct bewijs ontbreekt, er wel aanwijzingen zijn dat er een relatie bestaat tussen de mondgezondheid en algemene gezondheid. De afgelopen jaren zijn bij onderzoek steeds vaker associaties gevonden tussen de mondgezondheid en systemische aandoeningen als hart- en vaatziekten, diabetes type 2 en reumatoïde artritis. Zo zijn er bijvoorbeeld bij patiënten met reumatoïde artritis in het synovium bacteriën gevonden afkomstig uit parodontitis. (Olsen et al, 2014).
Tot slot zijn er geen nadelen voor de gezondheid van de patiënt verbonden aan ‘extra’ tandheelkundige controles, in tegenstelling tot antibioticaprofylaxe. Een goede kosteneffectiviteitsanalyse is niet haalbaar, gezien de onmogelijkheid die al bleek voor de antibiotische profylaxe (overweging 6).
Gezien bovenstaande argumenten komt de werkgroep er toe een goede mondhygiëne bij prothese patiënten niet voor te schrijven maar wel te adviseren, inclusief regelmatige tandheelkundige controles daarop.
Conclusie
|
|
Omdat een zekere relatie tussen een verminderde mondhygiëne en het ontstaan van hematogene PJI niet is aangetoond, maar er wel toenemend aanwijzingen zijn dat de mondgezondheid invloed heeft op algemene gezondheid, is het zinvol om bij patiënten het belang van goede mondhygiëne te benadrukken en regelmatige tandheelkundige controles aan te raden. |
8 Antibacteriële mondspoelingen
Het gebruik van antibacteriële mondspoelingen is mogelijk een alternatieve methode om bacteriemiën te voorkomen of te verminderen. Door voorafgaand aan een tandheelkundige ingreep te spoelen met bactericide middelen zoals chloorhexidine (CHX) wordt de orale bacterial load verminderd en daarmee de bacteriëmie. Hoewel het een plausibele gedachte is, zijn de onderzoeksresultaten omtrent de effectiviteit van chloorhexidine mondspoeling 0,12% en 0,2% niet eenduidig. In de literatuur wordt CHX mondspoeling in enkele gerandomiseerde trials vergeleken met placebo.
Tomás concludeert op basis van een RCT, met 53 controle (placebo) vs. 53 case-patiënten (CHX 0,2%), dat 30 seconden voor de tandheelkundige ingreep spoelen met CHX 0,2% een significante reductie gaf van incidentie bacteriëmie ten opzichte van de controlegroep. De reductie was zichtbaar bij t=30sec. (96% vs. 79%, P=0,008), t=15min. (64% vs. 30%, P <0,001) en t=1uur (20% vs. 2%, P = 0,005) (Tomás, 2007). Het routinematig gebruik van CHX mondspoeling voor extractie wordt dan ook door de auteurs aanbevolen. Een significante reductie in bacteriëmie bij gebruik van CHX mondspoeling wordt ook door anderen beschreven (Tuna, 2012; Ugwumba, 2014).
In een RCT met 201 patiënten die een tandextractie ondergingen vergeleek Barbosa onder andere het effect van CHX 0,2% op de duur van de bacteriëmie met een controlegroep. Hieruit concludeerde hij dat spoelen met CHX 0,2% voor een tandheelkundige ingreep de duur van een bacteriëmie significant verminderd. Opvallend is echter dat de groep die behandeld werd met CHX 0,2% mondspoeling + supragingivale irrigatie géén verkorte bacteriëmie duur gaf ten opzichte van de controlegroep (Barbosa, 2015).
Lockhart daarentegen vond, in een eerdere dubbelblinde gerandomiseerde trial met 70 patiënten (placebo vs. CHX 0,2%), dat het krachtig spoelen met CHX vóór een tandextractie geen significante verbetering gaf in de soort bacterie of incidentie (94% vs. 84%) van bacteriëmie (Lockhart, 1996). Hij concludeerde, net als andere auteurs, dat het gebrek aan data over de voordelen van antibacteriële mondspoelingen betere onderzoeksresultaten vereist voordat routinematig gebruik geadviseerd kan worden (Maharaj, 2012; DuVall, 2013). Het vergelijken van de studies is ook hier niet goed mogelijk in verband met de variabiliteit in behandelprocedure, meetmethoden en patiëntenpopulatie.
Hoewel CHX mondspoeling een lokaal werkend middel is, zitten er wel mogelijke nadelen aan het gebruik van CHX. Als bijwerkingen worden onder andere, hoewel zeldzaam, wederom allergie en anafylaxie beschreven. Tevens kost het eenmalig gebruik van 10ml CHX 0,2% mondspoeling ongeveer €0,20.
Conclusie
|
|
De literatuur is niet eenduidig over het effect van CHX mondspoeling. Er kan geen conclusie worden getrokken over het potentieel positieve effect van CHX mondspoeling op de incidentie van een PJI na een tandheelkundige ingreep. |
Onderbouwing
Achtergrond
Een hematogene besmetting van gewrichtsprothesen wordt door een bacteriëmie veroorzaakt en is vergelijkbaar met het ontstaan van een endocarditis bij hartpatiënten. De bacteriëmie kan door een infectie elders in het lichaam ontstaan of door een ingreep veroorzaakt worden in een gebied met veel bacteriën. De mondholte is daar een voorbeeld van. De vraag is of profylaxe met een antibioticum als bescherming bij een ingreep door tandarts of Mondziekten, Kaak- en Aangezichtschirurg (MKA-chirurg) en overige mondzorgverleners nodig is om een hematogene infectie van een gewrichtsprothese te voorkomen.
In Nederland is hierover voor totale heupprothesen (THP) een advies opgenomen in de consensus Totale Heupprothese (Nederlandse Orthopaedische Vereniging, 2010; Swierstra, 2011), voor totale knieprothesen (TKP) wordt ook naar deze richtlijn verwezen. Het advies houdt in dat bij tandartsingrepen alleen antibioticaprofylaxe geadviseerd wordt, als ingrepen plaatsvinden in geïnfecteerd gebied en daarnaast ook bij alle invasieve procedures van ook andere disciplines, als een patiënt verminderde weerstand heeft.
In de praktijk werd het advies niet goed opgevolgd. De begrippen “verminderde weerstand” en “ geïnfecteerd” leidden tot onduidelijkheid. Dit alles is een reden om te komen tot een nieuwe richtlijn specifiek voor profylaxe bij tandheelkundige ingrepen. Andere ingrepen die tot hematogene infecties van gewrichtsprothesen zouden kunnen leiden komen in deze richtlijn dus niet aan bod en staan nog geformuleerd in de consensus THP, maar zouden in een toekomstige herziening van de consensus Total Heupprothese met deze richtlijn kunnen worden meegenomen. Deze richtlijn over antibioticaprofylaxe bij patiënten met een gewrichtsprothese staat geheel los en moet onderscheiden worden van richtlijnen ter preventie van endocarditis. Men moet zich ook realiseren dat de noodzaak van het geven van antibiotica bij de behandeling van infecties in de mondholte of elders noodzakelijk blijft indien het om therapeutische toepassing gaat. Doorgaans gaat het dan om een aantal dagen van antibiotische behandeling.
In 2013 werden in Nederland volgens de Landelijke Registratie Orthopaedische Implantaten (LROI) 25.642 totale heupprothesen (THP) en 21.654 totale knieprothesen (TKP) geplaatst, met in de laatste jaren vooral een sterke toename voor TKP (Nederlandse Orthopaedische Vereniging 2013), een stijgende trend die ook wereldwijd bestaat (Kurtz, 2007; Kurtz, 2008; Zimmerli, 2010; OECD, 2011; Lamagni, 2014).
In de periode 2009 tot 2013 was de registratiegraad van de LROI 98% en waren in het totaal 254.167 heup- en knieprothesen geplaatst. Het cumulatieve infectiepercentage van diepe gewrichtsprothese-infecties (prosthetic joint infection: PJI) is in Nederland ongeveer 1 tot 2% (Prezies, 2014). Voor het grootste deel gaat het om vroege of early (<3 maanden postoperatief) dan wel uitgestelde of delayed (drie maanden tot twee jaar) diepe wondinfecties, die vrijwel steeds ontstaan ten gevolge van een peroperatieve besmetting (surgical site infections: SSI). De late infecties (>2 jaar postoperatief) worden echter verondersteld meestal hematogeen veroorzaakt te zijn. Van alle diepe PJI zou 30 tot 40% hematogeen veroorzaakt zijn, meestal vanuit de huid of urinewegen (Ainscow, 1984; Kaandorp, 1997; Hamilton, 2008; Zimmerli, 2010) en ongeveer 10% van de hematogene infecties zou vanuit de mondholte veroorzaakt zijn (Uçkay, 2009), wat resulteert in een incidentie van ongeveer 0,08% voor hematogene PJI van mond- of tandheelkundige (THK) origine.
Conclusies
|
GRADE Zeer laag |
Er is geen bewijs dat het geven van profylactisch AB een effect heeft op de incidentie van hematogene PJI na een tandheelkundige ingreep.
Bronnen (Jacobsen, 1980; Ainscow, 1984; Waldman, 1997; LaPorte, 1999; Cook, 2007; Uçkay, 2009; Berbari, 2010b; Swan, 2010; Skaar, 2011) |
Samenvatting literatuur
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
- Is er verschil in het risico op hematogene infectie van de gewrichtsprothese tussen het altijd wél of nooit geven van antibioticaprofylaxe bij patiënten met een gewrichtsprothese die een tandheelkundige ingreep ondergaan?
Relevante uitkomstmaten
De werkgroep achtte hematogene infectie van de gewrichtsprothese een voor de besluitvorming kritieke uitkomstmaat. De werkgroep definieerde een relatieve risicoreductie van de gewrichtsprothese-infectie van 50% als een klinisch relevant verschil.
Negen onderzoeken zijn opgenomen in de uiteindelijke literatuuranalyse. De evidence tabellen hiervan en beoordeling van individuele studiekwaliteit kunt u in onder het tabblad “Evidence tabellen” vinden.
Beschrijving studies
De negen onderzoeken omvatten: één prospectieve case-control studie (Berbari, 2010b), twee retrospectieve case-control studies (Skaar, 2011; Swan, 2011), twee prospectief observationele cohort studies (Ainscow, 1984; Uçkay, 2009) en vier retrospectief observationele cohortstudies (Jacobsen, 1980; Waldman, 1997; LaPorte, 1999; Cook, 2007). In alle gevallen betreft het onderzoek van een patiëntenpopulatie die behandeld is met een arthroplastiek van de grote gewrichten te weten: knieën (Waldman, 1997; Cook, 2007; Swan, 2011), heupen (Jacobsen, 1980; LaPorte, 1999) of beide (Ainscow, 1984; Uçkay, 2009; Berbari, 2010b; Skaar, 2011). De prospectieve cohortstudies includeerden tussen de 1112 en 6101 gewrichtsprothesen, de retrospectieve cohortstudies includeerde tussen 1855 en 3502 gewrichtsprothesen, de retrospectieve case-control studies tussen 1000 en 1641 gewrichtsprothesen en de prospectieve case-control studie omvat 339 case en 339 controle patiënten. Alle studies hadden een gemiddelde follow-up van twee jaar of langer, met één studie tot wel tien jaar (Cook, 2007). Hoewel de uitkomstmaten per studie verschillen, heeft elke studie in meer of mindere maten gekeken naar de incidentie van hematogene PJI met een mogelijk tandheelkundige oorzaak. Sommige studies hielden een definitie van >6 maanden na arthroplastiek aan voor “late” PJI (Jacobsen, 1980; Waldman, 1997; LaPorte, 1999; Cook, 2007). Skaar hanteerde de grens van >1jaar als late infectie, maar meest gebruikt is grens van >2 jaar postoperatief. Antibioticaprofylaxe tijdens tandheelkundige ingrepen werd beschreven in vijf studies (Jacobsen, 1980; Ainscow, 1984; Waldman, 1997; LaPorte, 1999; Berbari, 2010b; Skaar, 2011). Berbari gaat als enige specifiek in op het effect van wél versus geen AB (antibiotica)-profylaxe op de incidentie van hematogene PJI na tandheelkundige ingreep. Skaar beschrijft in het bijzonder de invloed van invasieve tandheelkundige ingrepen op het ontstaan van PJI.
In bovenstaande artikelen worden ook verschillende risicofactoren voor het krijgen van PJI geanalyseerd: diabetes mellitus, reumatoïde artritis, BMI, ASA-score en revisie van arthroplastiek. Twee studies maken onderscheid in het soort tandheelkundige ingreep als risicofactor (Berbari, 2010b; Skaar, 2011).
Resultaten
Vier van de negen studies beschreven een incidentie van PJI na arthroplastiek van 1,2 tot 2% (Ainscow, 2009; Skaar, 2011; Swan, 2011). De incidentie van hematogene PJI varieerde in zeven van de studies tussen 0,1% en 1,7% (Uçkay: 0,12%, Ainscow: 0,27%; Cook: 0,5%; Swan: 1%; Jacobsen: 1,7%; LaPorte: 1,7%; Waldman: 1,7%). Een deel van de studies kon geen tandheelkundige oorzaak vinden voor hematogene PJI. Vier studies vermeldden wel het vermoeden van PJI met een tandheelkundige origine. De incidentie was 0,03% (Cook, 2007), 0,05% (Jacobsen, 1980), 0,1% (LaPorte, 1999) en 0,2% (Waldman, 1997). Hierbij moet worden vermeld dat een directe tandheelkundige oorzaak in geen van deze studies kon worden aangetoond. Cook geeft geen verdere uitleg van de redenering achter zijn conclusie ten aanzien van een tandheelkundige oorzaak. De drie overige studies vonden een tandheelkundige oorzaak aannemelijk indien een tandheelkundige ingreep had plaatsgevonden in de twee weken voorafgaand aan de PJI en er geen aanwijzingen waren voor verklarende infecties elders in het lichaam. Het lijkt het reëel om voor een schatting van de incidentie van met tandheelkundige ingrepen geassocieerde hematogene PJI de kleinste en grootste waarde uit de literatuur weg te laten, wat een geschatte incidentie oplevert van 0,05 tot 0,1%, wat kan passen bij de berekeningen, zoals in de inleiding zijn geciteerd.
De incidentie wordt ook wel uitgedrukt per prothese-jaren: Uçkay vond bij de 4002 heupprothesen zeven hematogene infecties in 50.000 patiënt-jaren: 1,4/10.000 (Uçkay, 2009). Ainscow berekende over een gemiddelde periode van zes jaar een jaarlijkse incidentie van 0,04% (Ainscow, 1984).
Berbari vergeleek als enige in een prospectieve case-control studie 339 patiënten mét een PJI van THP of TKP (case), met 339 controle patiënten zónder infectie die een gewrichtsprothese geplaatst kregen (Berbari, 2010b). Zij vonden geen verhoogd risico op PJI door hoog of laag risico tandheelkundige ingrepen in de afgelopen zes maanden of twee jaar. Tevens vonden zij geen positief effect (risicoreductie) van profylactisch antibiotica. Ook niet in een subgroep analyse van 35 patiënten met orale pathogene micro-organismen als mogelijke oorzaak van de PJI.
In de drie overige studies, die zowel een tandheelkundige ingreep als mogelijke oorzaak voor de PJI en het antibioticumgebruik beschreven, werd er geen significant effect gezien op het optreden van de infecties. Jacobsen beschreef één patiënt met een dentogeen abces die ondanks de antibioticaingreep hiervoor toch een infectie van de gewrichtsprothese ontwikkelde (Jacobsen, 1980). LaPorte, rapporteerde drie gevallen in deze context welke geen van allen AB-profylaxe hadden ontvangen (LaPorte, 1999). Waldman beschreef zeven infecties waarbij slechts één antibioticumprofylaxe had ontvangen voor de tandheelkundige ingreep (Waldman, 1997).
Skaar gaat specifiek in op de invloed van invasieve tandheelkundige ingreep op het risico van PJI. Van de 1000 patiënten die tijdens de survey een arthroplastiek (468 heup, 501 heup, 31 overig) hadden ondergaan, ontwikkelden 18 patiënten een PJI. Het percentage van PJI was niet significant verschillend in de groep die wél invasief tandheelkundig was behandeld (7/457 = 1,5%; 95%CI 0,4 tot 2,7%) ten opzichte van de groep die geen invasieve tandheelkundige ingreep had ondergaan (11/543 = 2,0%; 95%CI 0,8 tot 3,2%). Daarnaast waren de hazard ratio’s van alle tandheelkundige ingrepen in de voorafgaande 90 of 180 dagen kleiner dan één. Dit zelfde gold voor de odds ratio bij case-control analyse (Skaar, 2011).
Ook Swan vond geen significant verschil tussen de case en controlegroep in hun univariate analyse naar de effecten van tandheelkundige ingreep op het ontstaan van PJI (Swan, 2011).
De beschreven studies vertonen een grote mate van heterogeniteit en hebben elk methodologische beperkingen. Het opzetten van een studie met een hogere bewijskracht (bijvoorbeeld RCT) naar het effect van antibioticaprofylaxe op de incidentie van PJI, is gezien de lage incidentie logistiek bijna onmogelijk. Berbari heeft ondanks dit feit een goede poging gedaan, maar ook deze studie heeft zijn beperkingen. Zo werd er geen paired-matching verricht en keken de onderzoekers ondanks de prospectief genoemde opzet retrospectief naar de verrichtte tandheelkundige ingrepen en het antibioticumgebruik. Gezien de uiteenlopende lage incidentie van hematogene tandheelkundig veroorzaakte PJI en de methodologische beperkingen, kan er geen conclusie worden getrokken betreffende het effect van antibioticaprofylaxe op het voorkomen van een hematogene PJI na een tandheelkundige ingreep.
Bewijskracht van de literatuur
De in de literatuuranalyse geïncludeerde artikelen betreffen alle observationele studies. Observationele studies starten in de GRADE-methode op het bewijskrachtniveau ‘laag’. Op basis van studiekarakteristieken wordt dit level verhoogd, verlaagd of blijft het ongewijzigd.
De kwaliteitsbeoordeling van de studies heeft er toe geleid dat de bewijskracht voor deze uitkomstmaat: “hematogene PJI ten gevolgen van een tandheelkundige ingreep” van alle studies is verlaagd naar “zeer laag” vanwege beperkingen in de onderzoeksopzet, inconsistentie en een verminderde extrapoleerbaarheid (indirectheid).
Zoeken en selecteren
In de databases Medline (OVID), Embase and Cochrane is gezocht naar studies die onderzoek hebben gedaan naar hematogeen veroorzaakte gewrichtsprothese-infecties bij het altijd wél dan wel nooit geven van antibioticaprofylaxe bij patiënten met een gewrichtsprothese die een tandheelkundige of mondheelkundige ingreep ondergaan. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. In eerste instantie is er een literatuurzoekactie gedaan naar systematische reviews en RCTs: dit leverde 539 treffers op. In tweede instantie werd de search nog uitgebreid met observationele studies (289 treffers). Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Betreft primair (origineel) onderzoek of systematische review;
- Directe vergelijking tussen interventie en uitkomst;
- Studiepopulatie: patiënten met een gewrichtsprothese (met een afbakening van alleen; de grote gewrichten; schouder, knie, heup en ellenboog) die een tandheelkundige ingreep ondergaan, inclusief (dier) experimentele studies;
- Uitkomstmaat: hematogene infectie van de gewrichtsprothese.
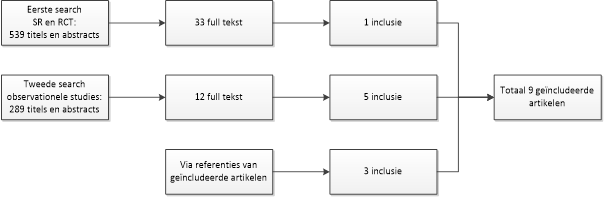
De selectie op basis van titel en abstract werd gedaan door de hele werkgroep (bij discrepantie gaf de voorzitter van de werkgroep de doorslag) en in eerste instantie werden er uit de eerste search 33 van de 539 studies geselecteerd. Na raadpleging van de volledige tekst door de hele werkgroep, werden vervolgens 32 studies geëxcludeerd voor de literatuuranalyse (zie figuur); negen van deze worden echter wel aangehaald in de overwegingen. Eén studie werd definitief geselecteerd (Berbari, 2010b). De werkgroep was van mening dat de literatuur niet volledig was. Daarom is een tweede search gedaan naar observationele studies. Op basis van titel en abstract (door twee werkgroepleden onafhankelijk van elkaar verricht) werden 12 studies geselecteerd. Na raadpleging van de volledige tekst werden vervolgens zeven studies geëxcludeerd voor de literatuuranalyse (zie figuur; zeven van deze worden echter alsnog aangehaald in de overwegingen) en vijf studies geïncludeerd (Jacobsen, 1980; Ainscow, 1984; Waldman, 1997; LaPorte, 1999; Skaar, 2011). Tevens zijn er nog drie studies (Cook, 2007; Uçkay, 2009; Swan, 2011) toegevoegd die naar voren kwamen uit de literatuurlijst van de geselecteerde studies en daarmee zijn er in totaal negen studies definitief geselecteerd voor de literatuuranalyse.
Figuur: Diagram van literatuursearch, leidend tot geïncludeerde artikelen
Referenties
- Abraham-Inpijn L. Prothesen en antibioticaprofylaxe. rubriek "Feedback post". Tandartspraktijk 2009;30(1):37-41.
- Agence francaise de sécurité sanitaire des produits de santé. Prescription des antibiotiques en pratique bucco-dentaire. http://ansmsantefr/content/download/5297/52416/ (downloaded 02-05-2015) 2011.
- Ainscow DAP, Denham RA. The risk of hematogenous infection in total joint replacements. J Bone Jt Surg 1984;66-B(4):580-2.
- American Academy of Orthopaedic Surgeons, American Dental Association. Prevention of orthopaedic implant infection in patients undergoing dental procedures. Evidence based guideline and evidence report. v0.2.2.2.2012; 2012. Website AAOS, Clinical Practice Guideline Unit: http://wwwaaosorg/Research/guidelines/PUDP/PUDP_guidelinepdf (access: 02-05-2015) 2012.
- American Academy of Orthopaedic Surgeons. Antibiotic prophylaxis for bacteremia in patientswith joint replacements. Information Satement. 2009. wwwaaosorg/about/papers/advistmt/1033asp (access 11-11-2012, removed from website) 2009.
- American Association for Gastrointestinal Gastroscopy. Antibiotic prophylaxis for GI endoscopy. Gastrointestinal Endoscopy 2008;67(6):791-8.
- American Dental Association, American Academy of Orthopaedic Surgeons. Antibiotic prophylaxis for dental patients with total joint replacements. Advisory statement. J Am Dent Assoc 1997;128(7):1004-8.
- American Dental Association, American Academy of Orthopaedic Surgeons. Antibiotic prophylaxis for dental patients with total joint replacements. J Am Dent Assoc 2003;134:895-9.
- American Dental Association. A legal perspective on antibiotc prophyalxis. J Am Dent Assoc 2003;134:1260.
- American Urological Association, American Academy of Orthopaedic Surgeons. Antibiotic prophylaxis for urological patients with total joint replacements. J Urol 2003;169:1796-7.
- Barbosa M, Prada-López I, Álvarez M, et al. Post-tooth extraction bacteraemia: a randomized clinical trial on the efficacy of Chlorhexidine prophylaxis PLoS One 2015;10(5):e0124249.
- Barrington JW, Barrington TA. What is the true incidence of dental pathology in the total joint arthroplasty population? J Arthroplasty 2011;26(6 Suppl.1):88-91.
- Bartzokas CA, Johnson R, Martin MV, et al. Relation between mouth and hematogenous infection in total joint replacements. Br Med J 1994;309:506-8.
- Berbari EF, Baddour LM, Carr A, et al. Reply to Friedlander 2010; CID 50: 1682. Clin Inf Dis 2010a;50(12):1683.
- Berbari EF, Osmon DR, Hanssen AD, et al. Dental procedures as risk factors for prosthetic hip or knee infection: a hospital based prospective case-control study. Clin Inf Dis 2010b;50(1):8-16.
- Blomgren G. Hematogenous infection of total joint replacement. An experimental study in the rabbit. Acta Orthop Scand Suppl 1981;52(Suppl 187):1-64.
- Brennan MT, Kent ML, Fox PC, et al. The impact of oral disease and nonsurgical treatment on bacteremia in children. J Am Dent Assoc 2007;138(1):80-5.
- Centraal Bureau voor Statistiek. statline. http://statlinecbsnl/Statweb/publication/?DM=SLNL&PA=03799&D1=37-50&D2=0-17&D3=0&D4=a&VW=T [cited 2015 Jan 25] 2015.
- Chen A, Haddad F, Lachiewicz P, et al. Prevention of late PJI. J Arthroplasty 214;29(Suppl 1):119-28.
- College voor zorgverzekeringen (CVZ). Handleiding voor kostenonderzoek. http://wwwzorginstituutnederlandnl/binaries/content/documents/zinl-www/documenten/publicaties/overige-publicaties/1007-handleiding-voor-kostenonderzoek/1007-handleiding-voor-kostenonderzoek/Handleiding+voor+kostenonderzoekpdf (access 10-04-2015) 2010.
- Colterjohn B, de Beer J, Petrucelli D, et al. Antibiotic profylaxis for dental procedures at risk of causing bacteremia among pos-total joint replacement patients: a survey of Canadian Orthopaedic Surgeons and Dental Surgeons. J Arthroplasty 2014;29:1091-7.
- Cook JL, Scott RD, Long WJ. Late hematogenous infections after total knee arthroplasty: experience with 3013 consecutive total knees. J Knee Surg 2007;20(1):27-33.
- Dajani AS, Taubert KA, Wilson WR, et al. Prevention of bacterial endocarditits: recommendations by the American Heart Association. Clin Inf Dis 1997;25:1448-58.
- DBC onderhoud. Opendisdata. http://wwwopendisdatanl/ [cited 2015 Apr 8] 2015.
- Deacon JM, Pagliaro AJ, Zelicof SB, et al. Prophylactic use of antibiotics for procedures after total joint replacement. J Bone Jt Surg 1996;78-A(11):1755-70.
- Dinsbach NA. Antibiotics in dentistry: Bacteremia, antibiotic prophylaxis, and antibiotic misuse. General Dentistry 2012;60(3):200-7.
- DuVall NB, Fisher TD, Hensley D, et al. The comparative efficacy of 0.12% chlorhexidine and amoxicillin to reduce the incidence and magnitude of bacteremia during third molar extractions: A prospective, blind, ransomized clinical trial. Oral Surg Oral Med Oral Pathol Oral Radiol 2013;115(6):752-63.
- Elson RA, Jephcott AE, McGechie DB, et al. Bacterial infection and acrylic cement in the rat. J Bone Joint Surg 1977;59-B(4):452-7.
- European Centre for Disease Prevention and Control (ECDC). Antimicrobial resistance surveillance in Europe 2013. http://ecdceuropaeu/en/publications/Publications/antimicrobial-resistance-surveillance-europe-2013pdf (access 10-04-2015) 2014.
- Forner L, Larsen T, Kilian M, et al. Incidence of bacteremia after chewing, tooth brushing and scaling in individuals with periodontal inflammation. Journal of Clinical Periodontology 2006;33(6):401-7.
- Friedlander AH. Oral cavity Staphylococci are a potential source of prosthetic joint infection. Letter to the editor. Clin Inf Dis 2010;50(12):1682-3.
- Gillespie W. Infection in total joint replacement. In: Osteomyelitis. (Ed Norden C). Ch. Philadelphia: Saunders; 1990;465-84.
- Guntheroth WG. How important are dental procedures as a cause of infective endocarditis? Am J Cardiol 1984;54(7):797-801.
- Hamilton H, Jamieson J. Deep infection in total hip arthroplasty. Can J Surg 2008;51(2):111-7.
- Hanssen AD, Osmon DR, Nelson CL. Prevention of deep prosthesis joint infection. J Bone Joint Surg Am 1996;78(3):458-71.
- Hendriks JGE, Neut D, van Horn JR, et al. Bacterial survival in the interfacial gap in gentamicin-loaded acrylic bone cements. J Bone Jt Surg Br 2005;87(2):272-6.
- Huotari K, Peltola M, Jämsen E. The incidence of late prosthetic joint infections: A register based study of 112 708 hip and knee replacements. Acta Orthopaedica 2015;86(3):321-5.
- Jacobsen PL, Murray W. Prophylactic coverage of dental patients with artificial joints: a retrospective analysis of thirty-three infections in hip prostheses. Oral Surgery 1980;50(2):130-3.
- Jacobson JJ, Schweitzer SO, Kowalski CJ. Chemoprophylaxis of prosthetic joint patients during dental treatment. A decision-utility analysis. Oral Surg Oral Med Oral Pathol 1991;72(2):167-77.
- Kaandorp CJE, Dinant HJ, van de Laar MAFJ, et al. Incidence and sources of native and prosthetic joint infection: a community based prospective survey. Ann Rheum Dis 1997;56:470-5.
- Kaandorp C, Schaardenburg van D, Krijnen P. Antibiotische preventie van hematogene bacteriële artritis. Ned Tijdschr Geneeskunde 1999;143(36):1808-11.
- Kotzé MJ. Prosthetic joint infection, dental treatment and antibiotic prophylaxis. Orthopedic Reviews 2009;1(1: e7):22-6.
- Krijnen P, Kaandorp CJE, Steyenberg EW, et al. Antibiotic prophylaxis for haematogenous bacterial arthritis in patients with joint disease: a cost effectiveness analysis. Ann Rheum Dis 2001;60:359-66.
- Kurtz SM, Lau E, Schmier J, et al. Infection burden for hip and knee arthroplasty in the United States. J Arthroplasty 2008;23(7):984-91.
- Kurtz SM, Ong KL, Schmier J, et al. Future clinical and economic impact of revision total hip and knee arthroplasty. J Bone Joint Surg Am 2007;89-A(Suppl 3):144-51.
- Kurtz S, Mowat F, Ong K, et al. Prevalence of primary and revision total hip and knee arthroplasty in the United States from 1990 through 2002. J Bone Joint Surg Am 2005;87-A(7):1487-97.
- Lamagni T. Epidemiology and burden of prosthetic joint infections. J Antimicrob Chemother 2014;69((suppl 1):i5-i10.
- LaPorte DM, Waldman BJ, Mont MA, et al. Infections associated with dental procedure in total hip arthroplasty. J Bone Joint Surg 1999;81-B(1):56-9.
- Legout L, Beltrand E, Migaud H, et al. Antibiotic prophylaxis to reduce the risk of joint implant contamination during dental surgery seems unnessary. Orthopaedics & Traumatology: Surgery & Research 2012;98:910-4.
- Little JW. Managing dental patients with joint prostheses. J Am Dent Assoc 1994;125:1374-8.
- Lockhart PB, Blizzard J, Maslow AL, et al. Drug cost implications for antibiotic profylaxis for dental procedures. Oral Surg Oral Med Oral Pathol 2013;115(3):345-53.
- Lockhart PB, Brennan MT, Sasser HC, et al. Bacteremia associated with toothbrushing and dental extraction. Circulation 2008;117(24):3118-25.
- Lockhart PB, Brennan MT, Thornhill M, et al. Poor oral hygiene as a risk factor for infective endocarditis-related bacteremia. J Am Dent Assoc 2009;140(10):1238-44.
- Lockhart PB. An analysis of bacteremias during dental extractions. A double-blind, placebo-controlled study of chlorhexidine. Archives of Internal Medicine 1996;156(5):513-20.
- Macy E. Penicillin and beta-lactam allergy: Epidemiology and diagnosis. Review. Curr Allergy Asthma Rep 2014;14(11):476 (doi: 10.1007/s11882-014-0476-y).
- Maharaj B, Coovadia Y, Vayej AC. A comparative study of amoxicillin, clindamycin and chlorhexidine in the prevention of post-extraction bacteraemia. Cardiovascular Journal of Africa 2012;23(9):491-4.
- Montfort van M, Oei S. Artritis gewrichtsprothesen door tandheelkunde ? Medisch Contact 2013;http://medischcontact.artsennet.nl/archief-6/tijdschriftartikel/135743/artritis-gewrichtsprothese-door-tandheelkunde.htm (Access: januari 2014).
- Murdoch DT, Roberts SA, Fowler VG, et al. Infection of orthopedic prostheses after Staphylococcus aureus bacteremia. Clin Inf Dis 2001;32(4):647-9.
- Nederland Huisartsen Genootschap. NHG-Standaard Diabetes mellitus type 2 (derde herziening). https://wwwnhgorg/standaarden/volledig/nhg-standaard-diabetes-mellitus-type-2 (downloaded 30 juni 2015) 2013.
- Nederlandse Orthopaedische Vereniging. Consensus Totale heupprothese. http://wwwkwaliteitskoepelnl/kwaliteitsbibliotheek/richtlijnen/?search=totale+heup&periode%5Bvan%5D=0&periode%5Btot%5D=0&_type=&specialisme=47 (access 10-04-2015) 2010.
- Nederlandse Orthopaedische Vereniging. Zicht op kwaliteit & veiligheid. Jaarrapportage uit de Landelijke Registratie Orthopaedische Implantaten 2013. http://issuucom/issuucomnov/docs/lroi-rapportage-2013-zicht-op-kwali?e=10174916/11547665 [cited 2015 Jan 15] 2013.
- Nelson J P, Fitzgerald R H, Jaspers M T, Little J W. Prophylactic antimicrobial coverage in arthroplasty patients. J Bone Jt Surg Am 1990;72(1):1.
- New Zealand Dental Association. Antibiotic prophylaxis for patients with prosthetic joint replacements undergoing dental treatment. Code of Practice. http://wwwjustsmileconz/_files/Prosthesis%20antibiotic%20Prophylaxispdf 2013.
- New Zealand Orthopaedic Association. Guidelines NZOA. http://wwwnzoaorgnz/guidelines 2014.
- NICE. Drug allergy: diagnosis and management of drug allergy in adults, children and young people. https://wwwniceorguk/guidance/cg183/resources/guidance-drug-allergy-diagnosis-and-management-of-drug-allergy-in-adults-children-and-young-people-pdf (access 1-04-2015) 2014.
- OECD. Health at a glance 2011: OECD indicators. http://dxdoiorg/101787/health_glance-2011-en (access 22-04-2015) 2011.
- Olsen I. The peridontal-systemic connection seen from a microbiological standpoint (the acta prize lecture 2014). Acta Odontologica Scandinavica 2015;73:563-8.
- Olsen I, Snorrason F, Lingaas E. Should patients with hip joint prosthesis recieve antibiotic prophylaxis before dental treatment ? Review article. J Oral Microbiology 2010;2:5265 - DOI: 10.3402/jom.v2i0.5265 (11 p).
- Otten R, van Roermund PM, Picavet HS. Trends in aantallen knie- en heuparthroplastieken: de vraag naar knie- en heupprotheses blijft voorlopig toenemen. Ned Tijdschr Geneeskunde 2010;154:A1534.
- Parvizi J, Gehrke T. Proceedings of the International Consensus Meeting on Periprosthetic Joint Infection. Data Trace Publishing Company, Maryland, USA: Maryland 2013.
- Poultsides LA, Papatheodorou LK, Karachalios TS, et al. Novel model for studying hematogenous infection in an experimental setting of implant-related infection by a community-acquired Methicillin-resistent S. aureus strain. J Orthop Res 2008;26:1355-62.
- Prezies. Referentiecijfers module POWI 2002 - 2011; tabel 12: percentage diepe wondinfecties naar risicofactor, per CTG code, met standaard methode surveillance na ontslag (SNO) (2013). http://wwwrivmnl/dsresource?type=pdf&disposition=inline&objectid=rivmp:232893&versionid=&subobjectname= (access: december 2014) 2014.
- Raber-Durlacher JE, Laheij AM, Epstein M, et al. Periodontal status and bacteremia with oral viridans streptococci and coagulase negative staphylococci in allogeneic hematopoietic stem cell transplantation recipients: A prospective observational study. Support Care Cancer 2013;21(6):1621-7.
- Rijnders BJA, Ceuppens JL, Peetermans WE. Management and choice of antibiotics for patients with an allergy for penicillin. http://wwwncbinlmnihgov/pubmed/10221094 (access10-04-2015) 1999.
- Roberts GJ. Dentists are innocent! Everyday bacteremia is the real culprit: a review and assessment of the evidence that dental surgical procedures are a principal cause of bacterial endocarditis in children. Pediatr Cardiol 1999;20(3):317-25.
- Rossi M, Zimmerli W, Furrer H, et al. Antibiotika zur Prophylaxe hämatogener Spätinfektionen von Gelenkprothesen (die Schweizerische Gesellschaft für Infektiologie). Schweiz Monatsschr Zahnmed 2005;115(6):571-5.
- Sandhu SS, Lowry JC, Reuben SF, et al. Who decides on the need for antibiotic prophylaxis in patients with major arthroplasties requiring dental treatment: is it a joint responsibility? Ann R Coll Surg Engl 1997;79:143-7.
- Schrama J C, Lutro O, Langvatn H, Hallan G, Espehaug B, Sjursen H, et al. Bacterial findings in infected hip joint replacement in patients with rheumatoid arthritis and osteoarthritis: a study of 318 revisions for infection reported to the Norwegian Arthroplasty Register. International Scholarly Research Network 2012;doi: 10.5402/2012/437675.
- Scott JF, Morgan D, Avent M, et al. Patients with artificial joints: do they need antibiotic cover for dental treatment? Austr Dent J 2005;50(4):S45-S53.
- Seymour RA, Whitworth JM, Martin M. Antibiotic prophylaxis for patients with joint prostheses - still a dilemma for dental practitioners. British Dental Journal 2003;194(12):649-53.
- Simmons NA, Ball AP, Cawson RA, et al. Case against antibiotic prophylaxis for dental treatment of patients with joint prostheses. Letter to Editor. Lancet 1992;339:301.
- Skaar DD, O'Conner H, Hodges JS, et al. Dental procedures and subsequent prosthetic joint infections. Findings from the Medicare Current Benificiary Survey. JADA 2011;142(12):1343-51.
- Slover JD, Philips MS, Iorio R, et al. Is routine antibiotic prophylaxis cost effective for total joint replacement patients? J Arthroplasty 2014;30(4):543-6.
- Sollecito P, Lockhart PB, Paumier TM, et al. The use of prophylactic antibiotics prior to dental procedures in patients with prosthetic joints. Evidence based guideline for dental practitioners - a report of the American Dental Association Council on Scientific Affairs. JADA 2015;146(1):11-6.e8.
- Southwood RT, Rice JL, McDonald PJ, et al. Infection in experimental hip arthroplasties. J Bone Jt Surg 1985;67-B(2):229-31.
- Steenbergen van LN, Denissen GA, Spooren A, et al. More than 95% completeness of reported procedures in the population-based Dutch Arthroplasty Register. External validation of 311,890 procedures. Acta Orthopaedica 2015;86(4):x-x.
- Steenbergen van LN. pers. e-mail communication to W.Rademacher dd. 01-01-2015. 2015.
- Stephánsdóttir A. pers. communication 21-09-2014, via e-mail GHIM Walenkamp 2014.
- SWAB. De kwaliteit van het antibioticabeleid in Nederland Advies aangaande het restrictief gebruik van antibiotica en het invoeren van Antibioticateams in de Nederlandse ziekenhuizen en in de eerste lijn. http://wwwswabnl/swab/cms3nsf/uploads/5FD2BE2700E8B433C1257A680028D9F0/$FILE/visiedoc%20SWAB%20vs%2021%20junifinalpdf (access 10-04-2015) 2012.
- Swan J, Dowsey M, Babazadeh S, et al. Significance of sentinel infective events in haematogenous prosthetic knee infections. ANZ J Surg 2011;81:40-5.
- Swedish Hip Arthroplasty Register. Annual report 2013. http://wwwshprse/Libraries/Documents/AnnualReport_2013Engsflbashx (cited 10-04-2015) 2013:17.
- Swedish Knee Arthroplasty Register. Annual Report 2014. http://wwwmykneese/pdf/SKAR2014_Eng_11pdf (access 10-04-2015) 2014:13-4.
- Swierstra BA, Vervest AMJS, Walenkamp GHIM, et al. Dutch guideline on total hip prosthesis. Acta Orthopaedica 2011;82(5):567-76.
- Thornhill MH, Dayer MJ, Prendergast B, et al. Incidence and nature of adverse reactions to antibiotics used as endocarditis prophylaxis. J Antimicrob Chemother 2015;[Epub ahead of print].
- Tomás I, Álvarez M, Limeres J, et al. Effect of a Chlorhexidine mouthwash on the risk of postextraction bacteremia. Inf Control Hosp Epidem 2007;28(5):577-82.
- Tomás I, Diz P, Tobias A, et al. Periodontal health status and bacteraemia from daily oral activities: Systematic review/meta-analysis. Journal of Clinical Periodontology 2012;39(3):213-28.
- Tong D, Theis J C. Antibiotic prophylaxis and invasive dental treatment in prosthetic joint patients. New Zealand Med J 2008;121(1280):45-52.
- Tsevat J, Durand-Zaleski I, Pauker SG. Cost-effectiveness of antibiotic prophylaxis for dental procedures in patients with artificial joints. Am J Public Health 1989;79(6):739-43.
- Tuna A, Arslan A, Gurol Y, et al. Do antibacterial mouthrinses affect bacteremia in third molar surgery? A pilot study. Austr Dent J 2012;57:435-9.
- Uçkay I, Hoffmeyer P, Trampuz A, Borens O, Terzic A, Scolozzi P, et al. Utilité de la prophylaxie antibiotique avant un geste dentaire pour les porteurs de prothèses totales du genou ou de la hanche. Revue Médicale Suisse 2010;6(727-730).
- Uçkay I, Lübbeke A, Emonet S, et al. Low incidence of haematogenous seeding to total hip and knee prostheses in patients with remote infections. J Infect 2009;59(5):337-45.
- Uçkay I, Pittet D, Bernard L, Lew D, Perrier A, Peter R. Antibiotic prophylaxis before invasive dental procedures in patients with arthroplasties of the hip and knee. J Bone Jt Surg 2008;90(7):833-88.
- Ugwumba CU, Adeyemo WL, Odeniyi OM, et al. Preoperative administration of 0.2% chlorhexidine mouthrinse reduces the risk of bacteremia asscociated with intra-alveolar tooth extraction. J Cranio Maxillo Facial Surgery 2014;42(8):1783-8.
- Vogely HC. Infections in orthopaedic surgery, clinical and experimental studies. Thesis Utrecht University, the Netherlands, 2000.
- Waldman BJ, Mont MA, Hungerford DS. Total knee arthroplasty infections associated with dental procedures. Clin Orthop Rel Res 1997;343:253-4.
- Watters W, Rethman MR, Hanson NB, et al. Prevention of orthopaedic implant infection in patients undergoing dental procedures. J Am Acad Orthop Surg 2013;21(3):180-9.
- Witsoe E. personal e-mail correspondence (09-12-2014). 2014.
- Young H, Hirsh J, Hammerberg EM, et al. Dental disease and periprosthetic Joint infection. Current concepts review. J Bone Joint Surg 2014;96(162-168).
- Zaura E, Cate ten J M. Towards understanding oral health. Caries Res 2015;49(suppl 1):55-61.
- Zimmerli W, Sendi P. Antibiotics for prevention of postprosthetic joint infection following dentistry: time to focus on data. Editorial commentary. Clin Inf Dis 2010;50(1):17-9.
- Zimmerli W, Zak O, Vosbeck K. Experimental hematogenous infecteion of subcutaneously implanted foreign bodies. Scand J Infect Dis 1985;17(3):303-10.
- Zimmerli W. personal e-mail communication GHIM Walenkamp 24-10-2013. 2013.
- Zorginstituut Nederland. Farmacotherapeutische Kompas. http://fkcvznl/preparaatteksten/a/amoxicillineasp [cited 2015 Feb 8] 2015a.
- Zorginstituut Nederland. Medicijnkosten. http://wwwmedicijnkostennl [cited 2015 Jan 12] 2015b.
- Zweedse richtlijn. Indikationer för antibiotikaprofylax i tandvården ny rekommendation (in Zweeds). http://wwwlakemedelsverketse/upload/om-lakemedelsverket/publikationer/information-fran-lakemedelsverket/2012/Rev%20130422_inneh%C3%A5llsf%C3%B6rt_Information%20fr%C3%A5n%20L%C3%A4kemedelsverket_nr%205_2012_webbpdf (access 30-09-2014) 2012
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Ainscow & Denham, 1984
|
Type of study: Prospective, observational cohort
Setting: Outpatient clinic, post-prosthesis placement.
Country: England
Source of funding: NA |
Inclusion criteria: People with an indication for a total joint replacement due to: - primary osteoarthritis; (81,4%) - secondary osteoarthritis; (5%) - Rheumatoid (RA) or related polyarthritis. (13,6%)
Exclusion criteria: NA
N total at baseline: 1000 pat (1112 total joint replacements)
Important prognostic factors2: mean age: 70yr (range 49 -85)
Sex: 28,4 % M
Type of arthroplasty: 88,5% Hip 11,5% Knee
Groups comparable at baseline? NA |
Describe intervention (treatment / procedure / test):
After joint placement (TKA or THA). The patients were not instructed to take antibiotics to cover dental or surgical procedures or any infection. They received antibiotics only when it was clinically indicated.
In order to assess the frequency of transient bacteraemia, each patient was sent a questionnaire asking about the occurrence of dental or surgical procedures and respiratory tract, urinary tract or skin infection since the arthroplasty.
A hematogenous cause for infection was recor-ded if the same organism was cultured from the primary site and the affected joint. |
Describe control (treatment / procedure / test): NA
|
Length of follow-up: Average: 6yr (range 3 -15 yr)
Loss-to-follow-up: NA
Incomplete outcome data: N 11,5% Reasons (describe) Unsatisfactorily completed questionnaires
|
Results: Infection: - 22 joints developed deep infections (overall incidence 0.27% and annual incidence of 0.04%):
128 patients had undergone dental procedures. None of these patients developed haematogenous infection.
Transient bacteraemia Of the 1000 questionnaires 896 were returned satisfactorily completed.
450 patients had not been at risk for transient bacteraemia.
228 patients developed urinary, respiratory or multiple infections. None of these developed haematogenous infection.
Of 40 patients who had recurrent skin ulceration and infection 3 developed hematogenous infection (7,5%) (P< 0,01). |
- Unclear how they come up with an overall incidence of 0.27% - Nothing is stated about the content of the questionnaire (which dental treatment etc.) - Nothing is stated about co-morbidity etc. - Due to the low incidence of PJI this cohort size is probably too small to investigate the effect of AB on the incidence of infection.
|
|
Berbari, 2010 |
Type of study: Prospective, observational case-control with retrospective collection of data
Setting: In hospital
Country: USA
Source of funding: NA |
Inclusion criteria: Case: patients with a diagnosis of prosthetic hip or knee infection who were hospitalized. Control: patients who were hospitalized on an orthopaedic service other than for PJI.
Exclusion criteria: NA
N total at baseline: Intervention: 339pt
Control: 339pt
Important prognostic factors2: For example Mean age (range) I: 69.5 (range, 25.7-91.2) C: 71.4 (range, 36.0-94.8)
Sex: I: 50 % M C: 47 % M
Groups comparable at baseline? No, the prosthesis age of the control group (49.9 months (range, 1.2dy-414)) was higher vs the case (15.5 months (range, 1dy-296))
|
Describe intervention (treatment / procedure / test):
After admission for PJI in the knee or hip dental records and structured forms where used to interview patients and abstract medical records data (incl. dental procedures). Dental records where obtained over the past two years.
|
Describe control (treatment / procedure / test):
Paired matching was not performed on any variable. Frequency matching was used between case and control on the location of joint arthroplasty. |
Length of follow-up: Previous 2 years before study date (date of admission). Study period: 2001-2006
Loss-to-follow-up: Intervention: N (%) NA Reasons (describe): NA
Control: N (%) NA Reasons (describe) Intervention: NA
Incomplete outcome data: N 1 (0,3%) Reasons (describe) No dental record was available for final analysis.
Control: N 2 (0.6%) Reasons (describe) No dental record was available for final analysis.
|
Results: A dental propensity score was calculated for each patient that took into account covariates that would predict the propensity of each patient to visit a dentist. The multiple variable models reported included the dental procedure, antibiotic prophylaxis, the dental propensity score, patient sex and joint age, as well as other covariates having a univariate P of ≤.010
Dental treatment in past 12 months
Case group: High-risk: 33.9%. Low-risk: 24.2%
Control group: High-risk: 55.7% Low-risk: 21.8%
In a multivariable model, low-risk or high-risk dental procedures performed within 6 or 24 months prior to hospital admission were not significantly associated with an increased risk of PJI compared to no treatment.
Low-risk dental procedure Odds ratio (case vs control):
In prior 6 months: - Edentulous: 1.8 (95%, CI 0.9-3.7) P=.10 - Low-risk procedure without AB-prophylaxis: 1.1 (95% CI 0.6-2.1) P=.77 - Low-risk procedure with AB-prophylaxis: 0.7 (95% CI 0.3-1.5) P=.33
In prior 24 months: - Edentulous: 1.7 (95%, CI 0.8-3.4) P=.16 - Low-risk procedure without AB-prophylaxis: 0.6 (95% CI 0.4-1.1) P=.11 - Low-risk procedure with AB-prophylaxis: 0.8 (95% CI 0.5-1.2) P=.29
High-risk dental procedure Odds Ratio (case vs control):
In prior 6 months: - Edentulous: 1.7 (95%, CI 0.9-3.5) P=.13 - High-risk procedure without AB-prophylaxis: 0.8 (95% CI 0.4-1.7) P=.60 - High-risk procedure with AB-prophylaxis: 0.5 (95% CI 0.3-0.9) P=.01
In prior 24 months: - Edentulous: 1.7 (95%, CI 0.8-3.4) P=.16 - High-risk procedure without AB-prophylaxis: 0.8 (95% CI 0.4-1.6) P=.56 - High-risk procedure with AB-prophylaxis: 0.7 (95% CI 0.5-1.1) P=.14
Other: Effect of at least 1 dental visit on prevention of prosthetic infection: OR 0.7 (95% CI, 0.5-1.03; P=.07)
Amount of hip or knee prosthesis infection caused by flora of potential oral origin: 35 (10.3%) After subgroup analysis comparing these 35 patients to a randomly selected group of 35 control patients no increased risk of total hip or knee infection was detected. |
- The authors state this is an prospective study. However they studied retrospectively for possible dental procedures. - no paired matching - High-risk procedure with AB-prophylaxis: 0.5 (95% CI 0.3-0.9) P=.01 is believed to be the result of potential unknown confounders or to the multiple comparisons pre-formed. |
|
Cook, 2007 |
Type of study: Retrospective observational cohort
Setting: Outpatient clinic
Country: USA
Source of funding: NA |
Inclusion criteria: All consecutive primary TKAs where included. All patients were instructed in the importance of AB-prophylaxis before dental treatment.
Exclusion criteria: NA
N total at baseline: N= 3013 TKA
Important prognostic factors2: Nothing is stated about the demographical characteristics of the overall study population
age ± SD: NA
Sex: NA
Groups comparable at baseline? NA |
Describe intervention (treatment / procedure / test):
Of these patients all hospital and office records were searched for documented infections (incl. length of time between TKA and infection, causing micro-organism, treatment and outcome)
|
Describe control (treatment / procedure / test): NA
|
Length of follow-up: Average: 10 yr Study period: 1985-2004
Knees loss-to-follow-up: Incomplete outcome data: NA Reasons (describe)
|
Results: Total TKA included: N=3013 TKA
Number of deep early (<6 months) infection of total TKA: N=0
Number of deep late (>6 months) infection of total TKA: N=15 (in 14 patients) (0,49% of total)
Interval between TKA and infection: 34months (range 10months- 6 yr)
All of these patients had at least one risk factor.
TKA infection with possible dental cause: N= 1 (0,03% of total) Nothing is stated about why the infection is due to dental work. Also the causing organism is unknown. |
- Costs are outlined in discussion - Not much information about the dental cause of PJI and AB prophylaxis, but gives an incidence of PJI. - focussed on the treatment of PJI en initial arthroplasty. |
|
Jacobsen, 1980 |
Type of study: Retrospective observational cohort
Setting: Outpatient clinic
Country: USA
Source of funding: |
Inclusion criteria: All patients receiving a THA during the period of 1970-1975.
Exclusion criteria: NA
N total at baseline: N= 1855
Important prognostic factors2: NA
Groups comparable at baseline? NA
|
Describe intervention (treatment / procedure / test):
All hospital charts of patients treated with a total hip arthroplasty between 1970-1975 were screened on early (<6 months after THA) and late (>6 months after THA) infections of the prosthesis.
|
Describe control (treatment / procedure / test): NA
|
Length of follow-up: Study period: 1970-1975
Loss-to-follow-up: Intervention: NA N (%) Reasons (describe)
Control: NA N (%) Reasons (describe)
Incomplete outcome data: Intervention: NA N (%) Reasons (describe)
Control: NA N (%) Reasons (describe) |
Results: Total THA screened: N=1855
Number of infection of the prosthesis: N= 33 ( 1.7%)
THA infection with possible dental cause: N= 1 (0.05% of total THA) (3% of all THA PJI) This patient developed PJI <2 weeks after dental treatment. The causative association is however speculative. Also, the patient was treated with antibiotics for the dental symptoms.
|
- The kind of bacteria associated with the PJI are also described in this article. None of them where matched to the oral microflora |
|
LaPorte, 1999 |
Type of study: Retrospective observational cohort study
Setting: Outpatient clinic
Country: USA
Source of funding: None |
Inclusion criteria: All patients treated with a THA between 1982-1994.
Exclusion criteria: NA
N total at baseline: 2973
Important prognostic factors2: No data of the demographical characteristics of the overall study population
For example: NA age ± SD: NA
Sex: NA
Groups comparable at baseline? NA |
Describe intervention (treatment / procedure / test):
All records of patients treated with a total hip between 1982-1994 arthroplasty were screened on deep late (>6 months after THA) infections of the prosthesis. Dental treatment was assessed by interviews with the patients and examination of medical records as well as other risk procedures (e.g. endoscopy).
|
Describe control (treatment / procedure / test): NA
|
Length of follow-up: Study period: 1982-1994 Follow-up after PJI with possible dental cause: up to 50 months.
Loss-to-follow-up: NA Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: NA N (%) Reasons (describe)
Control: NA N (%) Reasons (describe) |
Results: Number of late infection of THA: N=52 (1.7%)
THA infection with possible dental cause: N= 3 (0.1% of total THA) All of three of these patients underwent a dental procedure in the 2 week prior to PJI, lasting > 45min and without AB-prophylaxis.
|
- No data of the dental treatments of patients without PJI. - No data of the other 49 patients with PJI. - The putative oral micro-organisms causing the PJI were not matched with oral and blood samples. - Only hip prosthesis |
|
Skaar, 2011 |
Type of study: Retrospective database survey
Setting: Database survey
Country: USA
Source of funding: NA |
Inclusion criteria: All patients which where participants of ‘the Medicare Current Beneficiary Survey’ (MCBS) between 1997-2006 and reported specific procedure codes.
Exclusion criteria: NA
N total at baseline: N=1000
Important prognostic factors2: NA
Type of arthroplasty: Total joint arthroplasty
Groups comparable at baseline? NA |
Describe intervention (treatment / procedure / test): First, all patient who had undergone total joint arthroplasty while in the survey where identified. A time-to-event analysis was performed to determine if dental treatment in the past 90- to 180days was associated with PJI (if it occurred in the patient). |
Describe control (treatment / procedure / test): After identifying the patients with PJI a nested case-control analysis was conducted. Three patients who had undergone an arthroplasty during the survey but without PJI where selected for each case and matched on age, sex and comorbidity.
|
Length of follow-up: NA Loss-to-follow-up: NA
Incomplete outcome data: NA
|
Results: arthroplasty: Hip: N=468 Knee: N=501 Other: N=31
Infection: PJI after arthroplasty during survey: N=18 (1,8%)
Dental treatment and PJI PJI after dental treatment: N= 7/457 (1,5%) PJI without dental treatment: N11/543 (2,0%) No statistical difference.
Prior dental procedures where not associated with an increased risk of PJI. Hazard ratios (HRs) and Odds ratios (OR) were less than 1 for all procedures, but not significantly <1.0.
Only four case patients had undergone dental invasive treatment in the same year as the PJI. All of them where treated with prophylactic antibiotics. |
|
|
Swan, 2010 |
Type of study: Retrospective, single centre, case-controlled.
Setting: In-hospital
Country: Australia
Source of funding: NA |
Inclusion criteria: Patients who were diagnosed with PJI >3month after implantation.
Exclusion criteria: Patients with PJI< 3month after implantation or >3 months after implantation but with earlier symptoms.
N total at baseline: 1641
Important prognostic factors2:
Type of arthroplasty: Knee arthroplasty
Groups comparable at baseline? NA |
Describe intervention (treatment / procedure / test): Patients who were diagnosed with PJI of the knee >3month after implantation.
|
Describe control (treatment / procedure / test): For each infected case, three matched controls were identified from an institutional database and matched for age, sex and surgery date.
|
Length of follow-up: 12 months or more (98%) (mean 3.8 yrs) Loss-to-follow-up: 1,2% death and 1,5% suboptimal follow-up
Incomplete outcome data: NA
|
Results: Infection: N=37/1641 (2.2%) N= 26/1641 (1,6%) which resulted after more than 3 months after surgery N= 17/1641 (1%) classified as haematogenous
Dental cause of PJI: In the univariate ana-lysis of sentinel events there was no significant difference between de case and control patients concerning dental treatment. |
- |
|
Uçkay, 2009 |
Type of study: Prospective observational cohort
Setting: In hospital
Country: Switzerland
Source of funding: NA |
Inclusion criteria: All patients undergoing primary or revision total hip and knee replacement.
Exclusion criteria: Patients undergoing arthroplasty at other institute.
N total at baseline: N= 6101 elective arthroplasties. (Hip= 4002 Knee= 2099)
Important prognostic factors2: mean age69.9yr (±11.4)
Arthroplasty: Primary: 93% Revision: 7%
Sex: 40% M 60% F
Groups comparable at baseline? NA
|
Describe intervention (treatment / procedure / test):
Patients where followed according to the standard post-operative scheme. Electronic databases of Laboratory of Bacteriology were from there on retrospectively searched for any bacteriological cultures and positive and negative cultures where obtained.
Also, in case on PJI, medical records where screened for a clinical remote source of infection. The cause of PJI was divided into primary surgical site infection and a remote infection.
|
Describe control (treatment / procedure / test): NA |
Length of follow-up: 1996-2008, Mean follow-up was 70 months (range 3-154 months).
Loss-to-follow-up: Intervention: N (%) NA Reasons (describe)
Control: NA N (%) Reasons (describe)
Incomplete outcome data: Intervention: NA N (%) Reasons (describe)
Control: NA N (%) Reasons (describe)
|
Results: Primary outcome: - The total incidence of PJI: 1.2% (71/6101) - The incidence PJI associated with remote infection in patients who had undergone total hip or knee arthroplasty: 0.1% (7/6101)
Secondary outcome: - Incidence of remote infections in the cohort: 553 potential infectious episodes. - Potential risk factors primary PJI after multivariate logistic regression:
- Patients sustaining a hematogenous infection did not substantially differ from those with surgical site infections |
- None of the PJI associated with remote infection where due to dental treatment or pathology. - of 553 remote infection n=3 (dental abscess) where of dental origin.
|
|
Waldman, 1997 |
Type of study: Retrospective observational cohort
Setting: Outpatient clinic
Country: USA Source of funding: NA |
Inclusion criteria: All patients who were treated with a total knee arthroplasty (TKA) between 1982-1993.
Exclusion criteria: NA
N total at baseline: N= 3490
Important prognostic factors: Nothing is stated about the demographical characteristics of the overall study population
age ± SD: NA
Sex: NA
Groups comparable at baseline? NA
|
Describe intervention (treatment / procedure / test):
All records of patients treated with a TKA between 1982-1993 were screened on deep late (>6 months after TKA) infections of the prosthesis. Dental treatment was assessed by interviews with the patients and examination of medical records as well as other risk procedures (e.g. endoscopy).
|
Describe control (treatment / procedure / test): NA
|
Length of follow-up: Study period: 1982-1993, after presentation of PJI the average follow-up was 60 months (range 25-121 months)
Knees loss-to-follow-up:
Incomplete outcome data: N= 2 (related to dental treatment) of the total of 74 the patients with late PJI of the knee (2.7%). Reasons (describe) No dental record could be obtained due to retirement of dentists. Patients where extensively interviewed. |
Results: Total TKA included: N=3502, (incl. 12 referred patients from elsewhere with the diagnosis of late PJI of the knee)
Number of late infection of total TKA: N=74 (2.1%) Institute own TKA: N= 62 (1.7%)
TKA infection with possible dental cause: N= 9 of total PJI (0.25%) N= 7 of institute own PJI (0.2%) All of these patients underwent a dental procedure in the 2 week prior to PJI. The average time of treatment was 115 min (range, 75-205min) Only one person received one dose of pre-operative AB-prophylaxis. |
- only knee PJI - 21 of 74 PJI had no definitive source of infection. - No bacterial culture and matching techniques where reported - No data of dental treatment of patients without PJI |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-01-2016
Laatst geautoriseerd : 01-01-2016
Geplande herbeoordeling : 01-01-2021
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kims.orde.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doelgroep: Patiënten met een gewrichtsprothese die een tandheelkundige ingreep moeten ondergaan.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten die te maken hebben met gewrichtsprothese en tandheelkundige ingrepen (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- prof. dr. Geert H.I.M. Walenkamp, emeritus hoogleraar orthopaedie Maastricht (voorzitter);
- dr. Dirk Jan F. Moojen, orthopaedisch chirurg OLVG Amsterdam;
- dr. Hans (J.) G.E. Hendriks, orthopaedisch chirurg, Orthopedie Groot-Eindhoven;
- prof. dr. Fred R. Rozema, MKA chirurg Haga Ziekenhuis Den Haag, bijzonder hoogleraar Medisch Tandheelkundige Interactie, ACTA Amsterdam;
- drs. Theo A. Goedendorp, tandarts Maarssen;
- drs. Willem M.H. Rademacher, arts onderzoeker afdeling Medisch Tandheelkundige Interactie, ACTA Amsterdam;
Met ondersteuning van:
- drs. Sabrina B. Muller – Ploeger, adviseur Kennisinstituut van Medisch Specialisten, Utrecht
Met dank aan:
- prof. dr. Luzi Abraham-Inpijn, emeritus hoogleraar algemene ziekteleer en interne geneeskunde ACTA/AMC (adviseur van de werkgroep)
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
Getekend |
|
Walenkamp |
Emeritus hoogleraar orthopaedie |
Incidenteel audit orthopedisch infectieprobleem ziekenhuis, met name postoperatieve infecties en operatiekamer problematiek. Betaald. |
geen |
geen |
geen |
geen |
geen |
geen |
ja |
|
Moojen |
Orthopedisch chirurg, OLVG Amsterdam |
Penningmeester NOV Werkgroep Orthopedische Infecties (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
ja |
|
Rademacher |
Arts-onderzoeker, afd. MTI, ACTA, Amsterdam |
Universitair docent, afd. MTI, ACTA, Amsterdam ANIOS, MKA-chirurgie, AMC, Amsterdam |
geen |
geen |
geen |
geen |
geen |
geen |
ja |
|
Hendriks |
Orthopedisch chirurg, Orthopedie Groot Eindhoven |
Plv lid RGS, Lid concilium orthopedicum, |
geen |
geen |
geen |
geen |
geen |
geen |
ja |
|
Goedendorp |
Tandarts |
Werkzaam voor de NMT obv vacatie |
geen |
geen |
geen |
geen |
geen |
geen |
ja |
|
Rozema |
MKA-chirurg Haga Ziekenhuis Den Haag |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
ja |
|
Muller - Ploeger |
Adviseur Kennisinstituut van medisch Specialisten |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
ja |
Inbreng patiëntenperspectief
Er is voor deze richtlijn geen patiëntenperspectief opgesteld.
Methode ontwikkeling
Evidence based
Implementatie
|
Aanbeveling |
Tijdspad voor implementatie: 1-3 jaar of >3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implementatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijken voor acties3 |
Overige opmerkingen |
|
Geef geen antibiotische profylaxe aan gewrichtsprothese patiënten vóór een mond- of tandheelkundige ingreep ter preventie van een hematogene gewrichtsprothese infectie |
<1 jaar |
Kosten-besparend |
Adequate verspreiding van richtlijn binnen de beroepsgroepen |
Onvermogen medici en tandartsen gewoonten te veranderen, defensieve geneeskunde, angst voor aansprakelijkheid |
Verspreiding achtergrond richtlijn, en argumenten via voordrachten en door artikelen in wetenschappelijke tijdschriften nationaal, eventueel internationaal |
Beroepsgroep (WV) tandheelkundigen en orthopaeden |
Een enquête onder tandartsen vóór en ná de invoering van de richtlijn kan zichtbaar maken of de implementatie naar behoren verloopt, en waar meer voorlichting nodig is |
|
Geef geen antibiotische profylaxe aan gewrichtsprothese patiënten, ook al heeft deze een verminderde immuniteit, vóór een mond- of tandheelkundige ingreep ter preventie van een hematogene gewrichtsprothese infectie |
<1 jaar |
Kosten-besparend |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
|
Benadruk bij de patiënt het belang van een goede mondgezondheid en raad regelmatige tandheelkundige controles aan |
<1 jaar |
Kosten-besparend |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
1 Barrières kunnen zich bevinden op het niveau van de professional, op het niveau van de organisatie (het ziekenhuis) of op het niveau van het systeem (buiten het ziekenhuis). Denk bijvoorbeeld aan onenigheid in het land met betrekking tot de aanbeveling, onvoldoende motivatie of kennis bij de specialist, onvoldoende faciliteiten of personeel, nodige concentratie van zorg, kosten, slechte samenwerking tussen disciplines, nodige taakherschikking, etc.
2 Denk aan acties die noodzakelijk zijn voor implementatie, maar ook acties die mogelijk zijn om de implementatie te bevorderen. Denk bijvoorbeeld aan controleren aanbeveling tijdens kwaliteitsvisitatie, publicatie van de richtlijn, ontwikkelen van implementatietools, informeren van ziekenhuisbestuurders, regelen van goede vergoeding voor een bepaald type ingreep, maken van samenwerkingsafspraken.
3 Wie de verantwoordelijkheden draagt voor implementatie van de aanbevelingen, zal tevens afhankelijk zijn van het niveau waarop zich barrières bevinden. Barrières op het niveau van de professional zullen vaak opgelost moeten worden door de beroepsvereniging. Barrières op het niveau van de organisatie zullen vaak onder verantwoordelijkheid van de ziekenhuisbestuurders vallen. Bij het oplossen van barrières op het niveau van het systeem zijn ook andere partijen, zoals de NZA en zorgverzekeraars, van belang.
Werkwijze
Aanleiding en knelpunteninventarisatie
Concrete aanleiding voor het ontwikkelen van deze richtlijnmodule waren vragen, onduidelijkheden en praktijkvariatie over de effectiviteit van het geven van antibioticaprofylaxe bij tandheelkundige ingrepen bij patiënten die een gewichtsprothese hebben. Essentieel hierbij was het verschijnen van een regionale richtlijn over dit onderwerp. In het artikel dat over deze regionale richtlijn werd gepubliceerd, pleitten de auteurs, huisarts Van Montfort en orthopeed Oei, als eersten in Nederland voor het ontwikkelen van een landelijke richtlijn (Van Montfort M; Oei S, Artritis gewrichtsprothesen door tandheelkunde?, Medisch Contact, juni 2013 ).
Uitgangsvragen en uitkomstmaten
De concept-uitgangsvraag is in de werkgroep besproken, waarna de werkgroep de definitieve uitgangsvraag heeft vastgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond. Dat wil zeggen, wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de uitgangsvraag aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de zoekverantwoording van de desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins, 2004).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het (beste) beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Naast de Nederlandse Orthopaedische Vereniging (NOV) en de Koninklijke Nederlandse Maatschappij tot bevordering der Tandheelkunde (KNMT), is de conceptrichtlijnmodule voor commentaar verstuurd naar de Nederlandse Vereniging voor Medische Microbiologie (NVMM), Vereniging voor Infectieziekten (VIZ), Nederlands Huisartsen Genootschap (NHG), Nederlandse Vereniging voor Reumatologie (NVR), Nederlandse Vereniging voor parodontologie (NVvP), Nederlandse Vereniging voor Traumachirurgie (NVT; sub vereniging van NIV), en de Nederlandse Vereniging Mondziekten Kaak en aangezichtschirurgie. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de Nederlandse Orthopaedische Vereniging (NOV) en de Koninklijke Nederlandse Maatschappij tot bevordering der Tandheelkunde (KNMT) voorgelegd voor autorisatie en door hen geautoriseerd (januari 2016).
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.

