Methylfenidaat bij ADHD bij volwassenen
Uitgangsvraag
Leidt medicamenteuze behandeling van volwassenen met ADHD met (langwerkend) methylfenidaat tot afname van ADHD-symptomen en tot een algehele klinische verbetering?
Aanbeveling
Methylfenidaat wordt als 1ste keuze aanbevolen in de medicamenteuze behandeling van volwassenen met ADHD (zie ook het advies over dexamfetamine, onder de module van dezelfde naam) (EB).
Overwegingen
De werkgroep is van mening dat jarenlange klinische ervaring heeft aangetoond dat methylfenidaat, mits door een deskundige voorgeschreven, veilig kan worden toegepast bij volwassenen.
De optimale dosering van methylfenidaat is individueel variabel en mede afhankelijk van de werkingsduur van het gebruikte middel (of middelen) (NICE guideline on ADHD 2009).
Een aantal bijwerkingen (droge mond, verminderde eetlust, gastro-intestinale bijwerkingen, angst, hartkloppingen, slaapproblemen en hoofdpijn; vooral in het begin) wordt gerapporteerd door patiënten die behandeld worden met methylfenidaat. Tijdens de medicamenteuze behandeling moeten deze bijwerkingen systematisch nagevraagd en geëvalueerd worden.
De werkgroep beschouwt deze bijwerkingen als relatief licht in vergelijking met bijwerkingen van andere psychofarmaca. De meeste patiënten verdragen de behandeling met methylfenidaat goed, tenzij onbehandelde comorbiditeit (vooral angst, depressie en verslaving) een rol speelt. In principe wordt daarom eerst de comorbiditeit behandeld voordat ADHD-medicatie wordt toegevoegd.
Onderbouwing
Achtergrond
Methylfenidaat is een indirect werkend sympathicomimeticum, dat in de hersenen de dopaminerge en noradrenerge neurotransmissie versterkt. Uit neuro-imagingonderzoek blijkt dat methylfenidaat de dopaminetransporter blokkeert, waardoor de heropname wordt geremd en de hoeveelheid beschikbare dopamine voor neurotransmissie toeneemt (Dresel e.a., 2000; Volkow e.a., 2002).
In de in het navolgende besproken onderzoeken werd gebruikgemaakt van verschillende preparaten (zowel kortwerkend methylfenidaat, als preparaten met verlengde afgifte), in één onderzoek werd dexmethylfenidaat (zuiver rechtsdraaiend methylfenidaat) gebruikt. (Spencer e.a., 2007).
Conclusies
|
Het is aannemelijk dat methylfenidaat bij de behandeling van ADHD bij volwassenen effectief is in het verminderen van ADHD-symptomen en in het bewerkstelligen van algehele klinische verbetering. |
Samenvatting literatuur
Beoordeelde onderzoeken
In deze meta-analyse van onderzoeken bij volwassenen (met en zonder comorbiditeit) met ADHD werden 20 RCT’s opgenomen, waarin de werkzaamheid van methylfenidaat vergeleken werd met die van placebo (Adler e.a., 2009a; Biederman e.a., 2006; 2010; Bouffard e.a., 2003; Carpentier e.a., 2005; Ginsberg & Lindefors, 2012; Jain e.a., 2007; Kooij e.a., 2004; Konstenius e.a., 2010; Levin e.a., 2001; 2006; 2007; Medori e.a., 2008; Reimherr e.a., 2007; Retz e.a., 2012; Rösler e.a., 2009; Schubiner e.a., 2002; Spencer e.a., 1995; 2005; 2007). Bij 9 van deze 20 RCT’s betrof het ADHD-patiënten met (diverse) psychiatrische comorbiditeit (Carpentier e.a., 2005; Ginsberg & Lindefors, 2012; Konstenius e.a., 2010; Levin e.a., 2006; 2007; Retz e.a., 2012; Schubiner e.a., 2002; Spencer e.a., 2005; 1995;). In 9 van deze 10 onderzoeken werd de werkzaamheid van methylfenidaat beoordeeld ten opzichte van placebo (Biederman e.a., 2010; Carpentier e.a., 2005; Ginsberg & Lindefors, 2012; Konstenius e.a., 2010; Levin e.a., 2007; Retz e.a., 2012; 1995; Schubiner e.a., 2002; Spencer e.a., 2005). In het laatste onderzoek (Levin e.a., 2006) werden methylfenidaat, bupropion en placebo met elkaar vergeleken.
Klinisch bewijs voor effectiviteit van methylfenidaat in vergelijking met placebo
De samenvatting van de wetenschappelijke evidentie is te vinden in tabel 1.
Twee RCT’s (Kooij e.a., 2004; Medori e.a., 2008) evalueerden de algehele ernst van ADHD op de uitkomstmaat, gebruikmakend van de Clinical Global Impression Scale for ADHD Severity (CGI-S). Een meta-analyse van deze twee onderzoeken liet zien dat methylfenidaat superieur is ten opzichte van placebo in het verminderen van de algehele ernst van ADHD op de uitkomstmaat (Z=7,57, p<0,0001). Ook Ginsberg en Lindefors (2012) zagen een soortgelijk effect (Z=4,56, p<0,00001) in een kleine groep mannelijke gevangenen met ADHD en comorbide persoonlijkheidsproblematiek.
In vijf onderzoeken werd het effect van de interventie op de kernsymptomen van ADHD, gemeten met door de onderzoekers ingevulde schalen (Adler e.a., 2009b; Biederman e.a., 2010; Jain e.a., 2007; Medori e.a., 2008; Reimherr e.a., 2007; Spencer e.a., 2007). Deze schalen waren ook bij vier onderzoeken met ADHD-patiënten met psychiatrische comorbiditeit ingevuld (Carpentier e.a., 2005; Ginsberg & Lindefors, 2012; Konstenius e.a., 2010; Spencer e.a., 2005). Drie onderzoeken evalueerden het effect met de CAARS (beoordelaarsversie) (Ginsberg & Lindefors, 2012; Jain e.a., 2007; Medori e.a., 2008), drie gebruikten de AISRS (Adler e.a., 2009a; Biederman e.a., 2010; Spencer e.a., 2005) en drie gebruikten de ADHD-Rating Scale (ADHD-RS) (Carpentier e.a., 2005; Reimherr e.a., 2005; Spencer e.a., 2007). De meta-analyse van deze onderzoeken toonde aan dat methylfenidaat effectiever was dan placebo in het verminderen van ADHD-symptomen (Z=2,67, p=0,008). De statistische heterogeniteit van de onderzoeken was evenwel erg groot (I2=96%); hiermee moet men rekening houden bij het interpreteren van de resultaten. De heterogeniteit is deels te verklaren doordat de diverse beoordelingsschalen die bij deze meta-analyse werden samengevoegd en door de inconsistentie van de resultaten van de verschillende onderzoeken.
Ook bij volwassenen met ADHD en psychiatrische comorbiditeit leverde de meta-analyse een positief behandeleffect op voor methylfenidaat in vergelijking met placebo (Z=2,28, p=0,02). Opnieuw was de statistische heterogeniteit erg groot (I2=88%). Gezien deze uitgesproken heterogeniteit (ook wat betreft de aard en de ernst van de comorbiditeit) was voor volwassen patiënten met ADHD en comorbiditeit geen definitieve conclusie te trekken over de effectiviteit van methylfenidaat, behalve dat de effectiviteit van methylfenidaat duidelijk lager is bij ADHD-patiënten met verslaving als comorbiditeit dan bij ADHD-patiënten zonder verslaving.
In zes RCT’s werd gebruikgemaakt van zelfrapportage-instrumenten (Bouffard e.a., 2003; Ginsberg & Lindefors, 2012; Jain e.a., 2007; Kooij e.a., 2004; Konstenius e.a., 2010; Medori e.a., 2008). Drie onderzoeken gebruikten de zelfrapportageversie van de Connors’ Adult ADHD Rating Scale (CAARS:S) (Bouffard e.a., 2003; Jain e.a., 2007; Medori e.a., 2008), terwijl Ginsberg en Lindefors (2012) en Kooij e.a. (2004) de zelfrapportageversie van de ADHD-Rating Scale (ADHD-R) gebruikten. Ook hier bleek methylfenidaat superieur ten opzichte van placebo in het verminderen van de kernsymptomen van ADHD in zijn algemeenheid (Z=2,59, p=0,010). De heterogeniteit was echter hoog (I2=78%), wat de GRADE-waardering van dit resultaat beïnvloedt.
Vijf onderzoeken (Biederman e.a., 2006; Jain e.a., 2007; Reimherr e.a., 2007; Rösler e.a., 2009; Spencer e.a., 2007) en daarnaast drie onderzoeken met ADHD-patiënten met comorbiditeit (Levin e.a., 2007; Schubiner e.a., 2002; Spencer e.a., 1995) gebruikten de algemene verbetering als behandeluitkomst, gemeten met de CGI-Improvement of AISRS. Het effect van methylfenidaat op algemene klinische verbetering bleek groot ten opzichte van placebo (Z=4,52, p<0,0001). De heterogeniteit was over het algemeen matig (I2=59%). De inconsistentie in de resultaten voor deze uitkomst was mogelijk een gevolg van de sterke placeborespons die in verschillende onderzoeken gevonden werd (Levin e.a., 2007; Rösler e.a., 2009; Spencer e.a., 2007).
Drie RCT’s (Adler e.a., 2009a; Biederman e.a., 2006; Kooij e.a., 2004) evalueerden de globale symptoomverbetering met gebruik van de Clinical Global Impression Scale Improvement (CGI-I). In deze meta-analyse was methylfenidaat superieur ten opzichte van placebo (Z=12,75, p<0,0001), er was echter een substantiële heterogeniteit (I2=99%), die verklaard kon worden door de inconsistentie in de resultaten.
Ten slotte beoordeelden verschillende onderzoekers de globale behandelrespons bij volwassenen met ADHD en comorbiditeit (Biederman e.a., 2010; Levin e.a., 2006; 2007; Retz e.a., 2012; Spencer e.a., 2005). Een gepoolde meta-analyse bracht geen significant behandeleffect aan het licht ten gunste van methylfenidaat of placebo (Z=1,07, p=0,28), met hoge heterogeniteit (I2=83%). Deze grote heterogeniteit was opnieuw te verklaren door de inconsistente resultaten van de vijf onderzoeken. Twee onderzoeken bij verslaafde patiënten (Levin e.a., 2006; 2007) vonden geen verschil tussen methylfenidaat of placebo. Daarentegen vonden Biederman e.a. (2010) (Z=3,67, p=0,0002) en Spencer e.a. (2005) (Z=3,70, p=0,0002) wel een significant effect van methylfenidaat ten opzichte van placebo.
Open onderzoek met methylfenidaat
De deelnemers aan de RCT met dexmethylfenidaat (Spencer e.a., 2007) kregen de mogelijkheid daarna deel te nemen aan een open vervolgonderzoek gedurende 6 maanden (Adler e.a., 2009a). Dit onderzoek toonde de veiligheid en blijvende effectiviteit van de medicatie aan met bescheiden bijwerkingen. De gegevens hierover zijn te vinden in tabel 3 en 4. Ook Ginsberg en Lindefors (2012) gaven de RCT naar OROS-methylfenidaat een vervolg met een open-labelonderzoek.
Veiligheid en bijwerkingen van methylfenidaat
Een overzicht van de bijwerkingen die tijdens de RCT’s gerapporteerd werden, is te vinden in tabel 5, evenals de relatieve risico’s per bijwerking en de gradering van het bewijs. De volgende bijwerkingen werden het vaakst gerapporteerd: hoofdpijn, prikkelbaarheid, verminderde eetlust, droge mond, angst, misselijkheid, palpitaties of tachycardie en slaapproblemen, inclusief slapeloosheid. In tabel 3 staan deze uitgebreider beschreven, met daarbij de relatieve risico’s per bijwerking, de gradering van het bewijs, en de onderzoeken waarin dit onderzocht werd.
Bij de meta-analyse van deze RCT’s werd geen verschil gevonden in uitvalspercentage tussen de actief behandelde groepen en de placebogroepen. Het relatieve risico op uitval tijdens het onderzoek was beperkt (1,15, 95%-BI 0,90-1,47). Voor afhaken wegens bijwerkingen werd wel een verschil gevonden: patiënten die tijdens het onderzoek methylfenidaat kregen, braken vaker hun deelname af vanwege bijwerkingen dan patiënten die placebo kregen (Z=3,24, p=0,001).
Samenvatting van het klinische bewijs voor methylfenidaat
Wetenschappelijk onderzoek toont aan dat het gebruik van methylfenidaat de ernst van de kernsymptomen van ADHD bij volwassenen vermindert, en dat hiermee een algehele klinische verbetering optreedt.
Volgens GRADE is er veel vertrouwen in de schatting van de uitkomst ‘afname van de algemene klinische ernst van ADHD op de uitkomstmaat (CGI-S ADHD)’. Bij de andere uitkomsten is het vertrouwen in deze schatting echter matig of weinig te noemen. Het verlaagde vertrouwen in het bewijs wordt veroorzaakt door risico op vertekening (risk of bias) in een gedeelte van de onderzoeken en inconsistenties als gevolg van de heterogeniteit van de onderzoeken. Een deel van de heterogeniteit van de onderzoeken kan verklaard worden door het gebruik van verschillende schalen om dezelfde uitkomst te meten, bijvoorbeeld de kernsymptomen van ADHD. Ze worden in dit overzicht samengevoegd om het algehele effect van methylfenidaat ten opzichte van placebo aan te geven. Bovendien maken verschillende onderzoeken melding van grote behandeleffecten, terwijl andere kleine effecten rapporteren, hetgeen de inconsistentie doet toenemen. Verschillende methodologische bewerkingen vragen om een voorzichtige interpretatie van de resultaten voor methylfenidaat.
Zoeken en selecteren
Zoekstrategie
Er werd een uitvoerig literatuuronderzoek uitgevoerd naar medicamenteuze interventies voor volwassenen met ADHD. Dit onderzoek resulteerde in 1192 referenties die potentieel relevant waren voor dit review. Van de 1192 referenties werd van 136 referenties in verband met mogelijke inclusie de volledige tekst opgevraagd. 1056 referenties werden geëxcludeerd, met als meest voorkomende redenen voor uitsluiting:
- het gebruikte medicijn viel niet onder dit overzicht;
- het onderwerp lag buiten het bestek van dit onderzoek;
- het artikel betrof geen patiëntgebonden onderzoek (bijv. een hoofdstuk uit een boek of commentaar, dan wel een secundaire analyse);
- de onderzochte populatie viel buiten het bestek van dit onderzoek (bijv. kinderen, of geen patiënten met ADHD).
Van de 116 referenties die mogelijk relevant waren, werden er 44 geïncludeerd en voldeden er 72 niet aan de inclusiecriteria, waardoor ze geëxcludeerd werden. Van de 44 geïncludeerde referenties die overbleven, betroffen 31 referenties oorspronkelijke onderzoeken (K=15 over methylfenidaat, K=4 over dexamfetamine, K=1 over bupropion, K=9 over atomoxetine, K=1 over MAOI’s (monoamine-oxidaseremmers) en K=1 anders). Verdere details over de geëxcludeerde onderzoeken zijn te vinden in de Appendix.
Daarnaast werden er 13 systematische reviews verkregen en werden de primaire gegevensbronnen van deze reviews beoordeeld op hun methodologische kwaliteit en op hun mogelijke inclusie in het review.
Hetzelfde literatuuronderzoek werd ook gebruikt om referenties te ziften voor de zoekvragen over therapietrouw en het risico op misbruik. Waar mogelijk werden er ook referenties verkregen door handmatig zoeken en werden referenties aangeleverd door de leden van de richtlijncommissie.
Op 5 maart 2013 vond een update van de literatuursearch plaats voor het hoofdstuk medicamenteuze behandeling. Deze update resulteerde in 403 referenties die potentieel relevant waren voor deze review. Van de 31 referenties die na de eerste zifting als mogelijk relevant werden beoordeeeld, werden 6 RCT’s en 1 systematic review geïncludeerd. 24 referenties voldeden niet aan de inclusiecriteria (vielen buiten de scope van de richtlijn, hadden geen placebogroep, waren open-labeltrials, waren post-hocanalyse van eerdere trials met uitkomstmaten buiten de scope van de richtlijn), waardoor ze geëxcludeerd werden.
Reviewprotocol
Het reviewprotocol (hieronder in schema) beschrijft de criteria voor de onderzoekspopulaties, de interventies, de vergelijkingen en de uitkomstmaten, die bij dit literatuuronderzoek naar medicamenteuze interventies bij volwassenen met ADHD gebruikt zijn.
|
Component |
Description |
|
Objectives |
To evaluate the clinical effectiveness of pharmacological interventions for adults with ADHD. |
|
Population |
Adults and adolescents aged 18 years and older with suspected ADHD
Excluded groups include: Children (≤18 years of age)
For literature with a sample comprising of both children and adults, we should include when at least 50% of the sample population are adults.
For comorbidities, we should consider a sample to have comorbidities when at least 50% of the sample has a current comorbid diagnosis. |
|
Intervention(s) |
Pharmacotherapy |
|
Comparison |
Placebo, treatment as usual, control |
|
Critical outcomes |
|
|
Search Strategy |
Databases: MEDLINE, Embase, PsycINFO, Cochrane. Dates searched up until: March 5th 2013 |
|
Minimum sample size |
|
|
Study setting |
|
|
Study design |
|
|
Review strategy |
|
|
DSM=Diagnostic and Statistical Manual; ICD=International Classification of Diseases; RCT=Randomised Controlled Trial. ITT=Intention To Treat |
|
Referenties
- Adler, L.A., Zimmerman, B., Starr, L.H., Silber, S., Palumbo, J., Orman, C., & Spencer, T. (2009a). Efficacy and safety of OROS methylphenidate in adults with attention deficit/hyperactivity disorder. Journal of Clinical Psychopharmacology, 29(3), 239-247
- Biederman, J., Mick, E., Surman, C., Doyle, R., Hammerness, P., Harpold, T., e.a. (2006). A randomized, placebo-controlled trial of OROS methylphenidate in adults with attention- deficit/hyperactivity disorder. Biological Psychiatry, 59, 829-835
- Bouffard, R., Hechtman, L., Minde, K., & Iaboni-Kassab, F. (2003). The efficacy of 2 different dosages of methylphenidate in treating adults with attention-deficit hyperactivity disorder. Canadian Journal of Psychiatry, 48(8), 546-554.
- Carpentier, P.J., Jong, C.A.J. de, Dijkstra, B.A.G., Verbrugge, C.A.G., & Krabbe, P.F.M. (2005). A controlled trial of methylphenidate in adults with attention deficit/hyperactivity disorder and substance use disorders. Addiction, 100, 1868-1874.
- Ginsberg, Y., & Lindefors, N. (2012). Methylphenidate treatment of adult male prison inmates with attention-deficit hyperactivity disorder: randomised double-blind placebo-controlled trial with openlabel extension. British Journal of Psychiatry, 200(1), 68-73.
- Jain, U., Hechtman, L., Weiss, M., Ahmed, T.S., Reiz, J.L., Donnelly, e.a. (2007). Efficacy of a novel biphasic controlled-release methylphenidate formula in adults with attention-deficit/hyperactivity disorder: Results of a double-blind, placebo-controlled crossover study. Journal of Clinical Psychiatry, 68, 268-277.
- Konstenius, M., Jayaram-Lindstrom, N., Beck, O., & Franck, J. (2010). Sustained release methylphenidate for the treatment of ADHD in amphetamine abusers: A pilot study. Drug and Alcohol Dependence, 108, 130-133.
- Kooij, J.J.S., Burger, H., Boonstra, A.M., Van Der Linden, P.D., Kalma, L.E., & Buitelaar, J.K. (2004). Efficacy and safety of methylphenidate in 45 adults with attention-deficit/hyperactivitydisorder. A randomised placebo-controlled double-blind cross-over trial. Psychological Medicine, 34, 973-982.
- Levin, E.D., Conners, C.K., Silva, D., Canu, W., & March, J. (2001). Effects of chronic nicotine and methylphenidate in adults with attention deficit/hyperactivity disorder. Experimental and Clinical Psychopharmacology, 9(1), 83-90.
- Levin, F.R., Evans, S.M., Brooks, D.J., Kalbag, A.S., Garawi, F., & Nunes, E.V. (2006). Treatment of methadone-maintained patients with adult ADHD: Double-blind comparison of methylphenidate, bupropion and placebo. Drug and Alcohol Dependence, 81, 137-148.
- Levin, F.R., Evans, S.M., Brooks, D.J., & Garawi, F. (2007). Treatment of cocaine dependent treatment seekers with adult ADHD: Double blind comparison of methylphenidate and placebo. Drug and Alcohol Dependence, 87, 20-29.
- Medori, R., Ramos-Quiroga, J.A., Casas, M., Kooij, J.J.S., Niemela, A., Trott, G-E., e.a. (2008). A randomized, placebo-controlled trial of three fixed dosages of prolonged-release OROS methylphenidate in adults with attention-deficit/hyperactivity disorder. Biological Psychiatry, 63(10), 981-989.
- National Institute for Health and Clinical Excellence (2008). NICE Guideline. Attention deficit hyperactivity disorder: Diagnosis and management of ADHD in children, young people and adults. Manchester: NICE. www.nice.org.uk.
- Reimherr, F.W., Williams, E.D., Strong, R.E., Mestas, R., Soni, P., & Marchant, B.K. (2007). A doubleblind, placebo-controlled, crossover study of osmotic release oral system methylphenidate in adults with ADHD with assessment of oppositional and emotional dimensions of the disorder. The Journal of Clinical Psychiatry, 68(1), 93-101.
- Retz, W., Rösler, M., Ose, C., Scherag, A., Alm, B., Philipsen, A., e.a.; Study Group. (2012). Multiscale assessment of treatment efficacy in adults with ADHD: a randomized placebo-controlled, multi-centre study with extended-release methylphenidate. World Journal of Biological Psychiatry, 13(1): 48-59.
- Rösler, M., Fischer, R., Ammer, R., Ose, C., Retz, W. (2009). A randomised, placebo-controlled, 24- week, study of low-dose extended-release methylphenidate in adults with attention-deficit/hyperactivity disorder. European Archives of Psychiatry and Clinical Neurosciences, 258, 120-129.
- Schubiner, H., Saules, K., Arfken, C.L., Johanson, C.-E., Schuster, C.R., Lockhart, N., e.a. (2002). Double-blind placebo-controlled trial of methylphenidate in the treatment of adult ADHD patients with comorbid cocaine dependence. Experimental and Clinical Psychopharmacology, 10(3), 286-294.
- Spencer, T.J., Adler, L.A., McGough, J.J., Muniz, R., Jiang, H., Pestreich, L., & Adult ADHD Research Group. (2007). Efficacy and safety of dexmethylphenidate extended-release capsules in adults with attention-deficit/hyperactivity disorder. Biological Psychiatry, 61(12), 1380-1387.
- Spencer, T., Biederman, J., Wilens, T., Doyle, R., Surman, C., Prince, J., e.a. (2005). A large, doubleblind, randomised clinical trial of methylphenidate in the treatment of adults with attentiondeficit/hyperactivity disorder. Biological Psychiatry, 57, 456-463.
- Spencer, T., Wilens, T., Biederman, J., Faraone, S.V., Ablon, J.S., & Lapey, K. (1995). A double-blind, crossover comparison of methylphenidate and placebo in adults with childhood-onset attention-deficit hyperactivity disorder. Archives of General Psychiatry, 52(6): 434-443. Stes, S., DHaenen, H., & Kooij, J.J. (2005). Attention deficit/hyperactivity disorder in adults. Tijdschrift voor Geneeskunde, 61(20), 1445-1455.
- Solanto, M.V., Arnsten, A.F.T., & Castellanos, F.X. (2001). Stimulant drugs and ADHD: Basic and clinical neuroscience. New York: Oxford University Press.
- Volkow, N.D., Wang, G.J., Fowler, J.S., e.a. (2004). Evidence that methylphenidate enhances the saliency of a mathematical task by increasing dopamine in the human brain. American Journal of Psychiatry, 161, 1173-1180.
Evidence tabellen
Table 1: Evidence profile for methylphenidate vs. placebo for adults with ADHD
|
Outcome |
ADHD Core Symptom Severity (CGI-S) |
Core ADHD Symptoms (investigator rated) |
Core ADHD Symptoms (self-report) |
Overall improvement |
Treatment Response |
|
STUDYID |
Medori2008 Kooij2004 Ginsberg2012 |
Adler2009b Jain2007 Medori2008 Reimherr2007 Spencer2007 Carpentier2005 Spencer2005 Ginsberg2012 Konstenius2010 Retz2012 |
Kooij2004 Jain2007 Medori2008 Bouffard2003 Konstenius2010 Ginsberg2012 |
Biederman2006 Jain2007 Reimherr2007 Rosler2009 Spencer2007 Comorbidities Levin2007 Schubiner2002 Spencer1995 |
Levin2006 Spencer2005 Levin2007 Biederman2010 Retz2012 |
|
Effect Size |
ADHD population =-0.86 [-1.08, - 0.64] COMORBIDITIES SMD=-2.14 [-3.06, -1.22] Pooled total: SMD=-1.10 [-1.73, -0.47] |
ADHD population SMD=-1.13 [-1.29, -0.98] COMORBIDITIES SMD=-0.82 [-1.52, -0.11] Pooled total: SMD=-1.01 [-1.55, -0.46] |
ADHD population SMD=-0.51 [-1.01, -0.01] COMORBIDITIES SMD=-0.78 [-2.14, 0.58] Pooled total: SMD=-0.58 [-1.02, -0.14] |
ADHD population RR=1.84 [1.48, 2.29] COMORBIDITIES RR=3.35 [0.85, 13.24] Pooled total: RR=2.03 [1.49, 2.77] |
Pooled total: RR=1.30 [0.80, 2.12] 1. Number of participants achieving a CGI ADHD improvement rating <3 at endpoint for comorbidities. RR=1.03 [0.25, 4.33] 2.Number of participants reporting >30% drop in AARS scores from baseline to endpoint for comorbidities (dichotomous outcome) RR=0.83 [0.60, 1.14] 3.Number of participants with comorbidities much or very much improved on CGI + >30% reduction in symptoms on AISRS at endpoint (dichotomous outcome) RR=4.06 [1.93, 8.55] 4.Number of participants much or very much improved on CGI + >30% reduction in symptoms on AISRS at endpoint (dichotomous outcome) RR=1.71 [1.28, 2.28] |
|
GRADE of evidence |
ADHD: High Comorbidities:Moderate 1 |
ADHD: Very low 2 3 Comorbidities: Very low 4 5 6 7 1 |
ADHD: Very Low 8 9 10 Comorbidities: Very low 11 12 |
ADHD: Moderate 13 Comorbidities: Very low 14 15 16 |
Response outcome 1: Very Low 17 18 19 Response outcome 2: Low 20 21 Response outcome 3: Moderate 22 Response outcome 4: Moderate 22 |
|
Number studies/participants |
(K=3, N=476) |
(K=10, N=1403) |
(K=6, N=554) |
(K=8, N=1081) |
(K=5, N=462) |
N.B.: SMD=Standardized Mean Difference, RR=Relative Risk Ratio
1 Patient group: Men in a high-security prison.
2 Randomisation procedure unclear in Jain2007 and Spencer2007. Jain2007 was a cross-over trial and pre-crossover data not reported, which could introduce bias into the analysis.
3 Very high heterogeneity (I squared=96%).
4 Carpentier2005 was a crossover trial with no pre-crossover data, which could introduce bias to the analysis.
5 Very high heterogeneity due to inconsistent results across two studies (I squared=84%).
6 Participants had substance use disorders (Carpentier2005, Konstenius2010), and multiple comorbidities (mainly with major depressive disorder) in the Spencer2005
7 Downgraded for imprecision due to wide confidence intervals which do not overlap.
8 Randomisation procedure unclear in Jain2007 and was a cross-over trial and pre-crossover data not reported, which could introduce bias into the analysis.
9 Very high heterogeneity (I squared valued=82%) across four studies which found inconsistent results.
10 Bouffard2003 was a crossover trial which did not report pre-crossover data and randomization method was inappropriate (double-blinding was not successful). This could introduce bias into
the analysis.
11 Ginsberg2012 Patient group: Men in a high-security prison. KONSTENIUS2010 patient group: ADHD and addicted to amphetamine.
12 Very broad CI (probably due to small patient numbers in the two studies).
13 Randomisation procedure unclear in Jain2007 and was a cross-over trial and pre-crossover data not reported, which could introduce bias into the analysis. Reimherr2007 cross-over trial
potential for carry-over effects; unclear how long wash-out period was; statistics like mean dosage were not reported (and have to be obtained from the author; Biederman2006 did not have an adequate explanation of randomisation or allocation concealment which could introduce selection bias.
14 Randomisation procedure not described adequately, or allocation concealment which could introduce selection bias.
15 Very high heterogeneity (I squared value=85%).
16 One study has very wide confidence intervals and one study crosses line of no effect. Optimal information size < 400 limiting our confidence in the precision of the estimate of the effect.
17 The majority of participants in Levin2006 had comorbid substance use or mood and anxiety disorders (100% opiate, other current conditions included 15-22% alcohol dependence, 15-24%
marijuana dependence, 41-64% cocaine dependence, 16-18% affective disorders, 12-21% anxiety disorders, 27-33% lifetime affective disorders, 3-12% lifetime anxiety disorders.
18 Small sample size.
19 High heterogeneity 89%.
20 Participants had comorbidities in both Levin2006 and Levin2007 (substance use disorders).
21 Both studies (Levin2006 and Levin2007) 95% CI cross the line of no effect. Sample size is small across both studies and therefore does not meet optimal sample size criteria of 400 per
outcome.
22 Small amout of events.
Table 2: Continued outcomes for methylphenidate vs. placebo for adults with ADHD
|
Outcome |
Attrition from trial (any reason) |
Attrition due to adverse events |
|
STUDYID |
Adler2009b Biederman2006 Biederman2010 Kooij2004 Levin2001 Medori2008 Reimherr2007 Rosler2009 Spencer2007 Comorbidities Ginsberg2012 Konstenius2010 Levin2007 Levin2006 Schubiner2002 Spencer1995 Spencer2005 |
Adler2009b Biederman2006 Biederman2010 Jain2007 Kooij2004 Medori2008 Rosler2009 Spencer2007 Comorbidities Ginsberg2012 Levin2007 Levin2006 Retz2012 Schubiner2002 Spencer2005 |
|
Effect Size |
1.15 [0.90, 1.47] |
RR=2.06 [1.40, 3.04] |
|
GRADE of evidence |
Overall Pooled: Very low 1 2 Attrition ADHD: Very low 1 3 4 Attrition comorbidities: Very low 4 5 6 |
Overall pooled: Very low 5 6 7 ADHD: Very low 4 8 Comorbidities: Very low 4 5 6 |
|
Number studies/participants |
(K=16, N=2302) |
(K=14, N=2277) |
1 Several studies had unclear randomisation and concealment procedures.
2 Moderate heterogeneity (I squared - 37%).
3 High heterogeneity (I squared value=62%).
4 Wide confidence intervals, many cross the line of no effect, limiting the precision of our estimate of the effect of
methylphenidate.
5 Randomisation procedure and concealement unclear in one study. One study does not specify reasons for attrition or
number of participants lost to follow-up.
6 Downgraded for indirectness as extrapolating from populations who have both ADHD and a comorbidity.
7 Less than 300 events.
8 Crossover trials in this outcome potential for carryover effects which affects the attrition rate. Several of the trials did not
use ITT or explicit methods to account for missing data.
Table 3: Open-label study of methylphenidate
|
Outcome |
Core ADHD symptoms |
Core ADHD symptom severity |
Improvement |
Attrition |
Attrition due to adverse events |
|
STUDYID |
Adler2009e |
Adler2009e |
Adler2009e |
Adler2009e |
Adler2009e |
|
GRADE of evidence |
Very low 1 2 |
Very low 1 2 |
Very low 1 3 2 |
Very low 1 4 2 |
Very low 1 2 |
|
Number of studies/partici-pants |
(K=1, N=170). |
(K=1, N=170). |
(K=1, N=170). |
(K=1, N=170). |
(K=1, N=170). |
Efficacy data not extractable as no control group; results in effect size are taken from the trial.
1 Downgraded for risk of bias as non-randomised and non-blinded open-label extension study.
2 Optimal information size (N>400) not met.
3 Only 7.8% of participants at the end of OLE trial were NOT rated as normal to mildly ill, but had more severe core symptoms.
4 High percentage of population lost to follow-up and high attrition rate in those who switched from placebo to d-MPH-ER between the double-blind and open-label phases.
Table 4: Adverse events: open-label study of methylphenidate
|
Outcome |
Headache |
Insomnia |
Decreased appetite |
Cardiovascular Events |
Attrition due to adverse events |
Unconscious |
|
STUDYID |
ADLER 2009e |
ADLER 2009e |
ADLER 2009e |
ADLER 2009e |
ADLER 2009e |
Ginsberg 2012 |
|
GRADE of evidence |
Very low 1 2 |
Very low 1 2 |
Very low 1 2 |
Very low 1 2 3 |
Very low 1 2 |
Very low 2 4 |
|
Number of studies/participants |
(K=1, N=170). |
(K=1, N=170). |
(K=1, N=170). |
(K=1, N=170). |
(K=1, N=170). |
(K=1, N=30) |
Efficacy data not extractable as no control group; results in effect size are taken from the trial and reported in the text1
1 Downgraded for risk of bias as non-randomised and non-blinded open-label extension study
2 Optimal information size (N>400) not met.
3 Slight increase in SBP (2.3 +/ 12.6 mg Hg), DBP (11.6 +/ 9.8 mm Hg) and pulse (3.7 +/ 11.3 bpm).
4 Downgraded for indirectness as extrapolating from populations who have both ADHD and a comorbidity.
Table 5: Adverse events for methylphenidate
|
Outcome |
Headache |
Decreased Appetite |
Dry Mouth |
GI symptoms |
Anxiety |
Nausea |
Palpitations |
Sleep problems |
|
Effect Size |
RR 1.25 [1.09, 1.43] |
RR 2.88 [1.86, 4.46] |
RR 3.33 [2.35, 4.72] |
RR 1.17 [0.44, 3.11] |
RR 3.80 [1.19, 12.10] |
RR 2.69 [1.75, 4.13] |
RR 2.24 [1.38, 3.65] |
RR 1.70 [1.35, 2.13] |
|
GRADE of evidence |
Very low 1 2 |
Very low 1 2 3 4 |
Low 2 3 |
Very low 2 5 6 |
Very low 2 3 6 |
Low 6 7 |
Low 2 6 |
Very low 3 6 7 |
|
Number studies/ participants |
K=13, N=1958 |
K=12, N=2049 |
K=10, N=2021 |
K=7, N=1182 |
K=7, N=1221 |
K=7, N=1424 |
K=6, N=1416 |
K=13, N=2155 |
|
Study IDs |
Adler2009b, Levin2007, Biederman2006, Biederman2010, Bouffard2003, Jain2007, Kooij2004, Medori2008, Reimherr2007, Retz2012, Schubiner2002, Spencer2005, Spencer2007b |
Adler2009b, Biederman2006, Biederman2010, Bouffard2003, Jain2007, Kooij2004, Medori2008, Reimherr2007, Rosler2009, Schubiner2002, Spencer2005, Spencer2007b |
Adler2009b, Biederman2006, Biederman2010, Jain2007, Kooij2004, Medori2008, Rosler2009, Retz2012, Spencer2005, Spencer2007 |
Biederman2006, Biederman2010, Kooij2004, Levin2007, Retz2012, Rosler2009, Spencer2005 |
Adler2009b, Biederman2006, Biederman2010, Jain2007, Medori2008, Reimherr2007, Schubiner2002 |
Adler2009b, Medori2008, Reimherr2007, Rosler2009, Retz2012, Schubiner2002, Spencer2005 |
Adler2009, Biederman2010, Kooij2004, Medori2008, Retz2012, Rosler2009 |
Adler2009b, Biederman2006, Biederman2010, Bouffard2003, Jain2007, Kooij2004, Medori2008, Levin2007, Reimherr2007, Rosler2009, Schubiner2002, Spencer2005, Spencer2007b |
1 Wide confidence intervals, many cross the line of no effect, limiting the precision of our estimate of the effect of methylphenidate.
2 Downgraded for indirectness as some of the studies included populations with both ADHD and comorbidities.
3 Crossover trials in this outcome potential for carryover effects which affects the attrition rate. Several of the trials did not use ITT or explicit methods to account for missing data.
4 High heterogeneity (I squared value=61%).
5 High heterogeneity (I squared value=87%).
6 95% CI shows includes both appreciable benefit and appreciable harm (confidence intervals cross line of no effect).
7 Downgraded for indirectness as extrapolating from populations who have both ADHD and a comorbidity.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 08-07-2015
Laatst geautoriseerd : 08-07-2015
Geplande herbeoordeling :
Uiterlijk in 2020 bepaalt het bestuur van de NVvP of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVvP is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In opdracht van de Nederlandse Vereniging voor Psychiatrie (NVvP) heeft de richtlijnwerkgroep ADHD bij volwassenen een monodisciplinaire richtlijn ontwikkeld over diagnostiek en medicamenteuze behandeling van ADHD bij volwassenen. De ontwikkeling van deze richtlijn werd gefinancierd vanuit het gealloceerde budget van de NVvP vanuit de Stichting Kwaliteitsgelden Medisch specialisten (SKMS) en methodologisch en organisatorisch ondersteund door het Trimbos-instituut.
De status van de richtlijn
De professionaliteit van hulpverleners in de gezondheidszorg brengt met zich mee dat zij (mede door het hanteren van een richtlijn) zo veel als mogelijk evidence-based handelen, volgens de laatste stand van de wetenschap. Wanneer richtlijnen door en binnen de beroepsgroep zijn opgesteld, normeren deze het medisch professioneel handelen en zijn ze een uitwerking van de medisch professionele standaard (Gevers & Aalst, 1998).
Richtlijnen zijn geen dwingende voorschriften, maar zo veel mogelijk op bewijs gebaseerde inzichten en aanbevelingen waaraan hulpverleners, organisaties, zorgverleners, beleidsmakers, inhoudelijk adviseurs en mensen met een psychiatrische diagnose kennis kunnen ontlenen om hoogwaardige zorg te verlenen, te waarborgen en te toetsen. De behandelaar kan, als hij of zij dat nodig acht, op basis van de eigen professionele autonomie afwijken van de richtlijn. Afwijken van richtlijnen is als de situatie dat vereist zelfs noodzakelijk, en dient schriftelijk te worden vastgelegd in het dossier (Wijmen e.a., 2004).
Uitgangsvragen
De richtlijn is ontwikkeld op geleide van uitgangsvragen, die gebaseerd zijn op knelpunten rondom diagnostiek en behandeling van volwassenen met ADHD, zoals tevoren aangegeven door patiëntenvereniging Impuls en leden van de NVvP middels een enquête. Deze uitgangsvragen zijn ook vastgesteld door NICE, op basis van een knelpuntenanalyse die is uitgevoerd in Engeland. De Nederlandse richtlijnwerkgroep heeft een deel van deze uitgangsvragen overgenomen voor de huidige richtlijn.
Een richtlijn is een document met praktische aanbevelingen. Dat betekent dat praktijkproblemen zo veel als mogelijk uitgangspunt zijn van de teksten in de richtlijn. De richtlijn is een document waarin staat hoe optimale diagnostiek en behandeling er inhoudelijk uitzien. In deze richtlijn worden de volgende ‘klinische uitgangsvragen’ behandeld in de verschillende modules.
Diagnostiek
Uitgangsvragen rond diagnostiek waren:
- Is er een gevalideerd instrument om de diagnose ADHD bij volwassenen betrouwbaar vast te stellen volgens de DSM-IV-criteria (Module CAADID)?
- Waar moet het afkappunt voor symptomen in de volwassenheid liggen om een betrouwbare diagnose ADHD bij volwassenen te kunnen stellen (Module DIS-L)?
Medicamenteuze behandeling
Uitgangsvragen rond medicamenteuze behandeling waren:
- Leidt medicamenteuze behandeling van volwassenen met ADHD met (langwerkend) methylfenidaat, amfetamine (dexamfetamine en/of l-amfetamine, lisdexamfetamine), modafinil, atomoxetine of bupropion tot afname van ADHD-symptomen en tot een algehele klinische verbetering?
- Welke strategieën in de medicamenteuze behandeling van ADHD bij volwassenen verhogen de therapietrouw?
- Wat is het risico op misbruik (abuse) of verslaving (addiction) bij het gebruik van methylfenidaat en dexamfetamine in de behandeling van volwassenen met ADHD?
Doel en doelgroep
Doelstelling
De richtlijn ADHD bij volwassenen geeft aanbevelingen en handelingsinstructies voor de diagnostiek en medicamenteuze behandeling van volwassenen met ADHD. De richtlijn geeft aanbevelingen ter ondersteuning van de praktijkvoering van psychiaters die betrokken zijn bij de zorgverlening aan volwassenen met ADHD. Op basis van de resultaten van wetenschappelijk onderzoek en overige overwegingen geeft de richtlijn een overzicht van goed (‘optimaal’) handelen als waarborg voor kwalitatief hoogwaardige zorg.
De werkgroep moedigt het opstellen van lokale zorgprogramma’s en protocollen op basis van deze richtlijn aan, omdat dit bevorderlijk is voor de implementatie van de in de richtlijn beschreven optimale zorg.
Indien de aanbevelingen uit deze richtlijn in de concrete situatie niet aansluiten bij de wensen of behoeften van de volwassene met ADHD, dan kan beredeneerd worden afgeweken van de richtlijn, tenzij de wensen of behoeften van de persoon met ADHD hem of haar naar de mening van de behandelaar kunnen schaden dan wel geen nut hebben.
Doelgroep
De primaire doelgroep van deze richtlijn zijn volwassenen en adolescenten vanaf 18 jaar, bij wie sprake is van (een vermoeden van) ADHD. In de afbakening van de werkgroep valt ook de groep ‘ouderen’ binnen de groep volwassenen. Hoewel diagnostiek en behandeling van ouderen met ADHD relatief nieuwe fenomenen zijn, en RCT’s met medicatie bij deze groep nog ontbreken, is uit onderzoek gebleken dat ADHD ook bij ouderen voorkomt bij wie behandeling geïndiceerd kan zijn.
Richtlijngebruikers
De ontwikkeling van richtlijnen voor de GGZ geschiedt primair ter verbetering van de kwaliteit van de zorgverlening. De gebruikers van de richtlijn zijn allen professioneel betrokken bij de zorg voor volwassenen met (mogelijk) ADHD.
Afbakening
De richtlijnwerkgroep ADHD bij volwassenen heeft zich enerzijds gericht op het in kaart brengen van de knelpunten rondom diagnostiek en behandeling van deze aandoening en anderzijds op de beschikbare wetenschappelijk evidentie op dit gebied, waaronder de Engelse NICE-richtlijn voor ADHD bij volwassenen (2008). De richtlijnwerkgroep formuleerde uitgangsvragen voor het ontwikkelen van de monodisciplinaire richtlijn ADHD bij volwassenen voor de volgende vier onderwerpen: 1. Diagnostiek; 2. Comorbiditeit; 3. Medicamenteuze behandeling; 4. Niet-medicamenteuze behandeling. De onderwerpen diagnostiek en medicamenteuze behandeling worden behandeld in deze eerste fase van de richtlijn. De andere onderwerpen worden in het vervolgproject, de Zorgstandaard ADHD voor alle leeftijden, aan deze richtlijn toegevoegd (zie Voorwoord). Dit betekent dat de onderhavige eerste fase van de richtlijn slechts een deel van de volledige diagnostiek en behandeling van volwassenen met ADHD betreft.
Samenstelling werkgroep
De monodisciplinaire richtlijn ADHD bij volwassenen is ontwikkeld door de richtlijnwerkgroep ADHD bij volwassenen, in opdracht van de NVvP.
De richtlijnwerkgroep, onder voorzitterschap van dr. Sandra Kooij, bestond uit psychiaters, die door de beroepsvereniging werden afgevaardigd en een arts/psychotherapeut, tevens voorzitter van patiëntenvereniging Impuls. De richtlijnwerkgroep werd methodologisch en organisatorisch ondersteund door het technisch team van het Trimbos-instituut. Dit technisch team bestond uit projectleiding, een informatiespecialist, literatuurreviewers en projectassistentie. De volgende schema’s geven een overzicht van de samenstelling van de richtlijnwerkgroep en het ondersteunend technisch team.
Leden werkgroep
|
|
Naam |
Organisatie |
Beroep |
|
1. |
Sandra Kooij, voorzitter, MD PhD |
PsyQ Den Haag |
Psychiater |
|
2. |
Marita Braam-van Neer, MD |
ZGP |
Psychiater |
|
3. |
Nannet Buitelaar, MD |
De Waag, onderdeel van de Forensische Zorgspecialisten |
Psychiater |
|
4. |
Pieter-Jan Carpentier, MD PhD |
Reinier van Arkel Groep |
Psychiater |
|
5. |
Lex Pull, MD |
Brijder Verslavingszorg (tot 1 mei 2012) |
Arts / Psychotherapeut/ Voorzitter patiëntenvereniging Impuls |
|
6. |
Jeannette Rutgers, MD |
Pro Persona |
Psychiater |
|
7. |
Laetitia Smarius, MD |
De Bascule |
Psychiater |
Methodologische ondersteuning
|
|
Naam |
Ondersteuning |
|
1. |
Hedda van ’t Land, MsC PhD |
Programmahoofd, Programma Zorginnovatie, Trimbos-instituut |
|
2. |
Danielle van Duin, MsC |
Projectleider / richtlijnadviseur, Trimbosinstituut |
|
3. |
Jolanda Meeuwissen, MsC |
Projectleider / richtlijnadviseur, Trimbosinstituut |
|
4. |
Marleen Hermens, MsC PhD |
Reviewer, Trimbos-instituut |
|
5. |
Matthijs Oud, MsC |
Reviewer, Trimbos-instituut |
|
6. |
Angita Peterse |
Informatiespecialist, Trimbos-instituut |
|
7. |
Laura Shields, MsC |
Reviewer, Trimbos-instituut / NICE |
|
8. |
Nelleke van Zon |
Projectassistent, Trimbos-instituut |
In totaal kwam de richtlijnwerkgroep voorafgaand aan de commentaarfase acht keer bijeen in een periode van 31 maanden (september 2010-april 2013). In deze periode werden de stappen van de methodiek voor evidence-based richtlijnontwikkeling (EBRO) doorlopen. Voorafgaand aan dit project verrichtte de informatiespecialist in overleg met de werkgroepleden op systematische wijze literatuuronderzoek en maakte een selectie in de gevonden onderzoeken (zie voor informatie over de zoekstrategie en de selectiecriteria het reviewprotocol). De reviewers van het Trimbos-instituut beoordeelden de kwaliteit en inhoud van de aldus verkregen literatuur en verwerkten deze in evidencetabellen, beschrijvingen van de wetenschappelijke onderbouwing en wetenschappelijke (gewogen) conclusies. Leden van de richtlijnwerkgroep gingen op basis van de gevonden literatuur met elkaar in discussie over overige overwegingen en aanbevelingen. De werkgroepleden schreven samen met het technisch team van het Trimbos-instituut de conceptrichtlijntekst, die ter becommentariëring openbaar werd gemaakt. De ontvangen commentaren van leden van de NVvP, en een klankbordgroep bestaande uit leden van patiëntenvereniging Impuls, hoogleraren psychiatrie en andere betrokkenen werden vervolgens verwerkt in een commentaartabel, die tijdens een werkgroep bijeenkomst werd besproken. Na het doorvoeren van de op deze bijeenkomst voorgestelde wijzigingen werd de definitieve richtlijn aan de opdrachtgever aangeboden. Hierop volgden autorisatie door de beroepsvereniging, druk en verspreiding.
Belangenverklaringen
De leden van de werkgroep hebben schriftelijk verklaard of ze gedurende de totstandkoming van de richtlijn een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Daarin zijn door de opdrachtgever, het uitvoeringsorgaan en de werkgroepleden van de richtlijn geen strijdigheden bevonden met de te verrichten taken voor de richtlijn. Deze procedure is vastgelegd conform de ´Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling´, opgesteld door de Koninklijke Nederlandse Academie van Wetenschappen (KNAW), Koninklijke Nederlandsche Maatschappij tot bevordering der Geneeskunst (KNMG), Gezondheidsraad (GR), Centraal BegeleidingsOrgaan (CBO), Nederlands Huisartsen Genootschap (NHG) en Orde van Medisch Specialisten (OMS) in 2012. Een overzicht van deze verklaringen ligt ter inzage bij de Nederlandse Vereniging voor Psychiatrie.
Methode ontwikkeling
Evidence based
Implementatie
Recent onderzoek laat zien dat er bij richtlijntrajecten voornamelijk aandacht is voor de ontwikkeling van de richtlijn. Planmatig opgezette invoering komt maar heel beperkt van de grond. Hierop dient gericht te worden aangestuurd door financiers, zodat hier al bij de start geld voor beschikbaar is. De Regieraad voor richtlijntrajecten onderschrijft dan ook een programmatische aanpak van de ontwikkeling, invoering én evaluatie van richtlijnen inclusief (financiële en organisatorische) middelen, om het gebruik van de richtlijnen te stimuleren, monitoren en evalueren. TNO, CBO en het Trimbos-instituut besloten deze opdracht samen uit te voeren, met als doel de complementaire inzichten en expertise te vertalen in een gemeenschappelijke visie op richtlijnen. Dit resulteerde in een praktisch instrument voor een analyse van richtlijntrajecten: Kwaliteit Richtlijnontwikkeling, Invoering en Evaluatie (KRIE). Voor informatie over implementatie en evaluatie van de richtlijn wordt verwezen naar de module Implementatie.
Werkwijze
De richtlijn is ontwikkeld volgens de methodiek van de evidence-based richtlijnontwikkeling (EBRO).
Zoekstrategie
Om de klinische uitgangsvragen te beantwoorden is door de informatiespecialist, in 15 overleg met de werkgroepleden, op systematische wijze literatuuronderzoek verricht en is een selectie gemaakt binnen de gevonden onderzoeken volgens vooraf vastgestelde selectiecriteria. Er is gezocht naar bestaande (buitenlandse) evidence-based richtlijnen voor de zorg aan volwassenen met ADHD, systematische reviews en oorspronkelijke onderzoeken. In de literatuursearches is gezocht naar literatuur in de Engelse, 20 Nederlandse, Franse, en Duitse taalgebieden. Voor het zoeken naar publicaties is gebruikgemaakt van de volgende informatiebronnen:
|
|
|
|
|
|
Selectiestrategie
Bij de selectie van artikelen zijn de volgende criteria gehanteerd:
- Geeft het onderwerp van het gevonden onderzoek voldoende antwoord op de uitgangsvraag (worden bijvoorbeeld de vastgestelde kritische en belangrijke uitkomstmaten in het onderzoek geëvalueerd)?
- Sluit de doelgroep van het gevonden onderzoek voldoende aan bij de doelgroep van de richtlijn, te weten volwassenen en adolescenten ouder dan 18 jaar bij wie men vermoedt dat zij ADHD hebben? (literatuur gezocht vanaf > 15 jaar)
- Is de bestudeerde groep voldoende groot (minimaal tien deelnemers per arm)?
- Is er sprake van een geschikte onderzoeksopzet om de uitgangsvragen te beantwoorden? Gaat het om een gerandomiseerde gecontroleerde trial (RCT), cohortonderzoek, cross-sectioneel onderzoek, patiënt-controleonderzoek of goed kwalitatief onderzoek (waaronder goed observationeel onderzoek en case series)? Bij een longitudinaal onderzoek: is er een voldoende lange follow-upperiode?
Zie voor meer informatie over de Zoekverantwoording en Evidence tabellen.
Beoordeling van de kwaliteit van het bewijs
De methodologische kwaliteit van de gebruikte artikelen is beoordeeld met voor het betreffende onderzoekstype relevante formulieren ter beoordeling van de methodologische kwaliteit, afkomstig van het EBRO-platform (Handleiding voor werkgroepleden CBO, 2005). Voor het bewijs rondom interventies is daarna het bewijs van de onderzoeken per uitkomstmaat gegradeerd volgens het GRADE-systeem. (GRADE staat voor: Grading of Recommendations Assessment, Development and Evaluation.) De kwaliteit van het bewijs kent daarbij vier niveaus, te weten: zeer laag, laag, matig en hoog. De studie-opzet bepaalt de uitgangspositie van de kwaliteit van bewijs. RCT’s hebben over het algemeen meer bewijskracht dan observationele studies. Daarom is hun uitgangspositie hoog, terwijl de uitgangspositie van observationele studies laag is. De kwaliteit van het bewijs per uitkomstmaat wordt, behalve door de methodologische kwaliteit van de individuele onderzoeken, ook bepaald door andere factoren, zoals de mate van consistentie van de gevonden resultaten uit de verschillende onderzoeken en de precisie van de gevonden uitkomst (zie de onderstaande tabel). GRADE is niet toegepast bij vragen rondom ‘case identification’ en diagnostiek. De belangrijkste reden hiervoor is dat GRADE momenteel nog vooral geschikt is voor interventieonderzoeken.
Tabel 1. Grade: Factoren voor downgraden en upgraden
Het niveau van de kwaliteit van het bewijs (zeer laag, laag, matig en hoog) verwijst naar de mate van vertrouwen dat men heeft in de schatting van het effect van een behandeling.
|
We downgraden het niveau van de kwaliteit van bewijs van studies met een hoge uitgangspositie (RCT’s), bij: |
We upgraden het niveau van de kwaliteit van bewijs van observationele studies bij: |
|
1. Beperkingen in de onderzoeksopzet of uitvoering (study limitations): hierbij gaat het om de methodologische kwaliteit. Voorbeelden zijn dat de randomisatieprocedure niet optimaal was, dat beoordelaars van subjectieve uitkomsten niet geblindeerd waren, dat er selectief is gerapporteerd over de uitkomsten en dat er veel uitvallers waren. |
1. Een groot effect (large magnitude of effect): hiervan is sprake als er in de resultaten een groot effect of een sterk bewijs van associatie gevonden wordt. Dit kan tot uitdrukking komen in de hoogte van het relatieve risico (RR). |
|
1. Inconsistentie van de resultaten (inconsistency): hierbij gaat het om heterogeniteit van de resultaten van verschillende studies. Er kunnen beperkingen zijn als er een grote variatie is in de schattingen van het effect van een behandeling of als er nauwelijks overlap is tussen de 95%-betrouwbaarheidsintervallen (BI’s). |
2. Mogelijke confounders die het ‘ware’ effect verminderd hebben (plausible confounding): hiervan kan sprake zijn als er een achterliggende variabele is, zoals de ernst van de aandoening van de patiënten die met het onderzoek meedoen, die van invloed is op het effect van de interventie. |
|
2. Indirect bewijs (indirectness): er worden twee soorten indirect bewijs onderscheiden. Enerzijds gaat het om indirecte vergelijkingen, bijvoorbeeld wanneer er alleen interventies met een placebo worden vergeleken en geen interventies met elkaar worden vergeleken. Anderzijds gaat het om verschillen in patiëntenpopulatie, inhoud van de interventie of keuze van de uitkomstmaten tussen de beschikbare studies en de uitgangsvraag die in de richtlijn wordt gesteld. |
3. Bewijs van een verband tussen de dosering en de repons (dose-response gradient): hiervan kan sprake zijn als stijgende doseringen van een bepaald medicijn meer effect geven.
|
|
3. Onnauwkeurigheid van de resultaten (imprecision): hierbij gaat het om de onzekerheid van de uitkomst, bijvoorbeeld als de 95%-BI’s heel breed zijn vanwege kleine patiëntenaantallen. |
|
|
4. Kans op selectieve publicatie (publication bias) van onderzoeken of uitkomstmaten. Een voorbeeld van een beperking is wanneer niet alle studies gepubliceerd worden, bijvoorbeeld kleine studies die geen effecten ten gunste van de interventie konden aantoonden. |
|
Samenvatten van de resultaten
Van elk artikel is een samenvatting gemaakt in een zogenaamde ‘evidencetabel’, waarin de belangrijkste kenmerken van individuele onderzoeken zijn opgenomen (bij een RCT zijn dat bijvoorbeeld het doel van het onderzoek, het onderzoeksdesign, patiëntenkenmerken, interventies, uitkomstmaten en de resultaten). De resultaten van onderzoeken naar case identification en diagnostiek zijn op beschrijvende wijze samengevat (narratieve review). Bij de uitgangsvragen over interventies was het oorspronkelijk doel om voor elke uitkomstmaat een meta-analyse uit te voeren, om de omvang van het klinisch effect van de interventie samen te vatten. De data uit oorspronkelijke onderzoeken werden hiervoor verwerkt in een forest plot, die een grafische weergave van de meta-analyse geeft (zie de onderstaande tabel voor een voorbeeld van een forest plot).
Tabel 2. Voorbeeld van een forest plot met toelichting
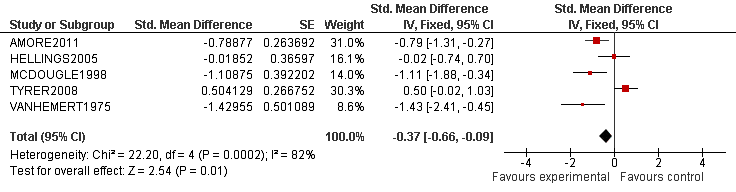
- De verticale lijn is de lijn van geen effect.
- Elke blokje geeft de puntschatting van het interventie-effect van een onderzoek aan.
- De grootte van het blokje correspondeert met het gewicht van het onderzoek binnen de meta-analyse.
- De horizontale lijn is een weergave van het betrouwbaarheidsinterval (95%-BI)
- De diamant is een weergave van het overalleffect (gemiddeld gewogen effect).
- De significantie van het overalleffect wordt onderaan de plot gegeven (z-score en p-waarde).
- De I2 geeft de mate van heterogeniteit van de studies aan (consistentie van de 10 resultaten).
Wanneer er onvoldoende data beschikbaar waren om een meta-analyse uit te voeren, stelden de reviewers een narratieve (beschrijvende) review van het beschikbare bewijs op. Bij de interventieonderzoeken is de waardering van de kwaliteit van het bewijs met behulp van de GRADE-methodiek in deze narratieve reviews opgenomen. De kwaliteitsbeoordeling en een samenvattende beschrijving van de verschillende onderzoeken worden voor elke uitgangsvraag gegeven onder het kopje ‘wetenschappelijke onderbouwing’.
Uitgangsvragen
De richtlijn is ontwikkeld op geleide van uitgangsvragen, die gebaseerd zijn op knelpunten rondom diagnostiek en behandeling van volwassenen met ADHD, zoals tevoren aangegeven door patiëntenvereniging Impuls en leden van de NVvP middels een enquête. Deze uitgangsvragen zijn ook vastgesteld door NICE, op basis van een knelpuntenanalyse die is uitgevoerd in Engeland. De Nederlandse richtlijnwerkgroep heeft een deel van deze uitgangsvragen overgenomen voor de huidige richtlijn.
Een richtlijn is een document met praktische aanbevelingen. Dat betekent dat praktijkproblemen zo veel als mogelijk uitgangspunt zijn van de teksten in de richtlijn. De richtlijn is een document waarin staat hoe optimale diagnostiek en behandeling er inhoudelijk uitzien. In deze richtlijn worden de volgende ‘klinische uitgangsvragen’ behandeld in de verschillende hoofdstukken.
Aanbevelingen
Aanbevelingen kunnen gegradeerd worden als sterk of zwak (voorwaardelijk). Wanneer de kwaliteit van het bewijs voor de positieve en negatieve effecten van een interventie hoog is, kan dit leiden tot een sterke aanbeveling, en omgekeerd, wanneer de bewijskracht laag tot zeer laag is, kan dit een zwakke aanbeveling opleveren. Een zwakke aanbeveling geeft meer ruimte om af te wijken en aandacht te schenken aan alternatieven die passen bij de behoeften van de patiënt, terwijl bij een sterke aanbeveling die ruimte beperkt is. De kracht van het wetenschappelijke bewijs is echter niet de enige factor die de sterkte van de aanbevelingen bepaalt. De aanbevelingen zijn gebaseerd op wetenschappelijk bewijs enerzijds en overige overwegingen anderzijds, zoals praktijkervaringen van de werkgroepleden, ervaringen en voorkeuren van mensen met ADHD en familie, kosten, beschikbaarheid (in verschillende echelons) en organisatorische aspecten. Deze laatste zijn opgenomen onder het kopje ‘Overige overwegingen’ (zie onderstaande tabel).
Tabel 3. Bepaling van de sterkte van aanbeveling
|
Sterkte van aanbeveling |
Kwaliteit wetenschappelijk bewijs: graad van evidentie |
Overige overwegingen: |
Implicaties |
|
1A = sterke aanbeveling |
Hoge graad van evidentie: RCT’s zonder beperkingen of sterk overtuigende evidentie van observationele onderzoeken |
Onder andere: voordelen overtreffen duidelijk de nadelen of risico’s |
sterke aanbeveling, kan worden toegepast bij de meeste mensen met een psychiatrische diagnose en in de meeste omstandigheden |
|
1B = sterke aanbeveling |
Matige graad van evidentie: RCT’s met beperkingen of sterke evidentie vanuit observationele onderzoeken |
Onder andere: voordelen overtreffen duidelijk de nadelen of de risico’s |
sterke aanbeveling, kan worden toegepast bij de meeste mensen met een psychiatrische diagnose en in de meeste omstandigheden |
|
1C = sterke aanbeveling |
Lage of zeer lage graad van evidentie: Uitkomsten van observationele onderzoeken of casestudies of RCT’s met veel beperkingen |
Onder andere: voordelen overtreffen duidelijk de nadelen of de risico’s |
sterke aanbeveling, maar dit kan veranderen als er hogere evidentie beschikbaar komt |
|
2A = zwakke aanbeveling |
Hoge graad van evidentie: RCT’s zonder beperkingen of sterk overtuigende evidentie van observationele onderzoeken |
Onder andere: evenwicht tussen voor- en nadelen of risico’s |
zwakke aanbeveling, de beste actie kan verschillen naar gelang de omstandigheden, mensen met een psychiatrische diagnose of maatschappelijke waarden |
|
2B = zwakke aanbeveling |
Matige graad van evidentie: RCT’s met beperkingen of sterke evidentie vanuit observationele onderzoeken |
Onder andere: evenwicht tussen voor- en nadelen of risico’s |
zwakke aanbeveling, de beste actie kan verschillen naargelang de omstandigheden, mensen met een psychiatrische diagnose of maatschappelijke waarden |
|
2C = zwakke aanbeveling |
Lage of zeer lage graad van evidentie: Uitkomsten van observationele onderzoeken of casestudies of RCT’s met veel beperkingen |
Onder andere: onzekerheid over voor- of nadelen - evenwicht tussen beide is mogelijk |
erg zwakke aanbeveling, alternatieven kunnen evengoed te verantwoorden zijn |
Tabel 4. Indeling van methodologische kwaliteit van individuele onderzoeken
|
|
Interventie |
Onderzoek naar diagnostische accuratesse |
Schade/bijwerkingen*, etiologie, prognose |
|
A1 |
Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controleonderzoek, cohortonderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohortonderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohortonderzoek of patiënt-controleonderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk, dan geldt de classificatie voor interventies.
|
We downgraden het niveau van de kwaliteit van bewijs van studies met een hoge uitgangspositie (RCT’s), bij: |
We upgraden het niveau van de kwaliteit van bewijs van observationele studies bij: |
|
1. Beperkingen in de onderzoeksopzet of uitvoering (study limitations): hierbij gaat het om de methodologische kwaliteit. Voorbeelden zijn dat de randomisatieprocedure niet optimaal was, dat beoordelaars van subjectieve uitkomsten niet geblindeerd waren, dat er selectief is gerapporteerd over de uitkomsten en dat er veel uitvallers waren. |
1. Een groot effect (large magnitude of effect): hiervan is sprake als er in de resultaten een groot effect of een sterk bewijs van associatie gevonden wordt. Dit kan tot uitdrukking komen in de hoogte van het relatieve risico (RR). |
|
1. Inconsistentie van de resultaten (inconsistency): hierbij gaat het om heterogeniteit van de resultaten van verschillende studies. Er kunnen beperkingen zijn als er een grote variatie is in de schattingen van het effect van een behandeling of als er nauwelijks overlap is tussen de 95%-betrouwbaarheidsintervallen (BI’s). |
2. Mogelijke confounders die het ‘ware’ effect verminderd hebben (plausible confounding): hiervan kan sprake zijn als er een achterliggende variabele is, zoals de ernst van de aandoening van de patiënten die met het onderzoek meedoen, die van invloed is op het effect van de interventie. |
|
2. Indirect bewijs (indirectness): er worden twee soorten indirect bewijs onderscheiden. Enerzijds gaat het om indirecte vergelijkingen, bijvoorbeeld wanneer er alleen interventies met een placebo worden vergeleken en geen interventies met elkaar worden vergeleken. Anderzijds gaat het om verschillen in patiëntenpopulatie, inhoud van de interventie of keuze van de uitkomstmaten tussen de beschikbare studies en de uitgangsvraag die in de richtlijn wordt gesteld. |
3. Bewijs van een verband tussen de dosering en de repons (dose-response gradient): hiervan kan sprake zijn als stijgende doseringen van een bepaald medicijn meer effect geven.
|
|
3. Onnauwkeurigheid van de resultaten (imprecision): hierbij gaat het om de onzekerheid van de uitkomst, bijvoorbeeld als de 95%-BI’s heel breed zijn vanwege kleine patiëntenaantallen. |
|
|
4. Kans op selectieve publicatie (publication bias) van onderzoeken of uitkomstmaten. Een voorbeeld van een beperking is wanneer niet alle studies gepubliceerd worden, bijvoorbeeld kleine studies die geen effecten ten gunste van de interventie konden aantoonden. |
|
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
