Intracranieel Meningeoom - Risicofactoren
Uitgangsvraag
Aanbeveling
De werkgroep is van mening dat overwogen moet worden hormoontherapie te stoppen bij groei van een meningeoom tijdens gebruik van exogene geslachtshormonen.
Overwegingen
Onderbouwing
Conclusies
Er zijn aanwijzingen dat de groeisnelheid van een bestaand meningeoom tijdens het 2e en 3e trimester van de zwangerschap kan toenemen.
Smith 2005 (44); Campbell 2009 (2)
Het is aannemelijk dat bestraling van de hersenen op kinderleeftijd een verhoogd risico geeft op het ontstaan van een meningeoom.
Taylor 2010 (21); Vinchon 2011 (22); Campbell 2009 (2)
Het is aannemelijk dat mobiele telefonie het risico op een meningeoom niet verhoogt.
Lahkola 2008 (30); Carlberg 2013 (32)
Er zijn aanwijzingen dat het gebruik van exogene geslachtshormonen een verhoogd risico geeft op een meningeoom.
Jhawar 2003 (41); Gil 2011 (42)
Samenvatting literatuur
Endogene factoren
Geslachtshormonen
Meningeomen komen twee tot drie keer vaker voor bij vrouwen dan bij mannen (1). Opmerkelijk genoeg komen atypische en anaplastische meningeomen meer voor bij mannen dan bij vrouwen (2). Progesteronreceptoren komen bij 57 tot 92% van alle meningeomen voor en een kleiner aantal meningeomen (30%) heeft oestrogeenreceptoren (1) (3) (4). Daarnaast worden zwangerschap, menopauze, en mammacarcinoom in verband gebracht met meningeomen (5) (6). Dit alles suggereert een hormonaal risicoprofiel voor het ontwikkelen van een meningeoom.
Zwangerschap
In een studie van Lee et al. was er een beschermende rol van een doorgemaakte zwangerschap op het ontstaan van meningeomen. Daarnaast was de kans op het ontwikkelen van een meningeoom kleiner na meerdere zwangerschappen en het doormaken van een zwangerschap op een jongere leeftijd (7). Een andere studie suggereert dat een doorgemaakte zwangerschap het risico op een meningeoom juist doet toenemen (8). Een cohortstudie waarin 276.212 vrouwen werden geïncludeerd, toonde geen associatie tussen zwangerschap en meningeomen (9).
Al bestaande meningeomen kunnen een versnelde groei vertonen in vooral het tweede en derde trimester van de zwangerschap en na de bevalling weer afnemen in omvang (10) (2). Een verklaring voor het verband tussen meningeomen en zwangerschap is tot nu toe niet gevonden. Mogelijk is de verhoogde progesteronspiegel in de zwangerschap een verklaring voor een versnelde groei van een al bestaand meningeoom (11).
Menopauze
Er zijn studies gepubliceerd over het risico op het ontstaan van een meningeoom in relatie tot het optreden van de menopauze met elkaar tegensprekende resultaten. Custer et al. laten zien dat vrouwen die recent postmenopauzaal zijn geworden een OR van 3,1 (95%BI: 1,2-7,9) hebben voor het ontwikkelen van een meningeoom ten opzichte van menstruerende vrouwen (3). Dit risico zou mogelijk afnemen tot een OR van 0,6 (95%BI: 0,2-1,9) wanneer zij al 10 jaar postmenopauzaal zijn. In het cohort onderzoek van Michaud et al. werd gerapporteerd dat peri- en postmenopauzale vrouwen een lager risico hebben op het ontwikkelen van meningeomen dan premenopauzale vrouwen (HR=0,63; 95%BI:0,34-1,17) (9).
Hatch et al. laten zien dat menopauze op latere leeftijd gerelateerd is aan een verhoogd risico op een meningeoom. De OR voor het ontstaan van een meningeoom voor vrouwen met een natuurlijke menopauze tussen de 48-52 jaar is 1,56 (95%BI: 0,59-4,13) in vergelijking met vrouwen die in de menopauze komen voordat ze 48 jaar zijn geworden. Voor vrouwen met een menopauze op een leeftijd ouder dan 52 jaar is in vergelijking met een menopauze voor de leeftijd van 48 jaar de OR 2,28 (95%BI: 0,82-6,36) (12). Omdat in andere studies vaak geen of een verlaagd risico op een meningeoom werd gevonden na de menopauze, kan op dit moment geen eenduidige conclusie worden getrokken over dit onderwerp (7) (13).
Co-morbiditeit
Mammacarcinoom:De relatie tussen mammacarcinoom en meningeoom is nog niet duidelijk. Custer et al. vonden een licht verhoogd risico op het ontwikkelen van een meningeoom bij vrouwen met een mammacarcinoom en vice versa (14). Mogelijk spelen dezelfde risicofactoren of een zelfde genetische predispositie voor mammacarcinoom en meningeoom een rol in de ontwikkeling van beide tumoren (15). Er werd géén associatie gevonden tussen het BRCA1 en BRCA2-gen en het ontwikkelen van een meningeoom (16).
Exogene factoren
Ioniserende straling
Ioniserende straling verhoogt de kans op het ontwikkelen van intracraniële tumoren, vooral van meningeomen (2) (16) (17). In een groep van overlevenden van de atoombom in Hiroshima die een stralingsdosis van >0,1Sv hadden gekregen, werd een significant hogere incidentie aan meningeomen gevonden in vergelijking met een controlegroep die niet was blootgesteld aan straling (p<0.005) (18). Bestraling van de hersenen (inclusief de hersenvliezen) op kinderleeftijd, geeft een verhoogd risico op stralingsgeïnduceerde meningeomen op latere leeftijd (19) (20) (21) (22). In tegenstelling tot idiopathische meningeomen komen stralingsgeïnduceerde meningeomen vaker voor op jongere leeftijd. Daarnaast zijn ze vaker multipel en hebben ze vaker atypische of zelfs anaplastische kenmerken. Na behandeling is de kans op een recidief groter. De periode waarin meningeomen na radiotherapie worden gevonden ligt tussen de 2-63 jaar (23) (24). Harrison et al. beschreven een latente periode van gemiddeld 35,2 jaar voor een door ioniserende stralingsgeïnduceerd meningeoom na een stralingsbelasting van 10 Gy radiotherapie. Na 10-20 Gy was dit 26,1 jaar en na meer dan 20 Gy stralingsbelasting 19,5 jaar (20). In een cohortstudie waarin bijna 18.000 5-jaars overlevers van kanker op de kinderleeftijd werden geïncludeerd, werd een lineaire toename van het risico op een meningeoom gevonden bij toename van de stralingsdosis op de meningen tot een 479-voudig verhoogd risico bij >40 Gy (21).
Vinchon et al. vonden bij kinderen die bestraald waren voor een hersentumor een cumulatief risico op een intracranieel meningeoom, oplopend van 5% na 10 jaar tot 30% na 20 jaar (22).
Enkele retrospectieve cohortstudies lieten een licht verhoogd risico op intracraniële meningeomen na tandheelkundige röntgenfoto's zien (25) (26). De gebruikte dosis bij tandheelkundige foto's is echter zo laag (microSv), dat hier geen hersenschade en daarmee geen verhoogd risico op hersentumoren te verwachten is. De retrospectieve cohortstudies zijn associatie-studies en een directe oorzaak-gevolg relatie tussen tandheelkundige foto's en het ontstaan van tumoren is tot nu toe niet aangetoond (27).
Tot slot werd in een retrospectieve cohortstudie een licht verhoogd risico gevonden op hersentumoren (waaronder meningeomen) bij kinderen die een CT-scan van de hersenen ondergingen vóór de leeftijd van 10 jaar (28).
Mobiele telefonie
De relatie tussen mobiele telefonie en meningeomen is uitvoerig onderzocht. Onderzoeken met een follow-up duur van tien jaar tonen aan dat er géén duidelijke relatie is tussen beiden (29) (30) (31) (32). Ook is er geen biologische rationale over hoe laag-energetische elektromagnetische straling een meningeoom kan veroorzaken (33). Desondanks heeft de WHO-IARC in een officieel rapport over mobiele telefonie en het ontstaan van hersentumoren de volgende conclusie opgenomen: ‘The electromagnetic fields produced by mobile phones are classified by the WHO-International Agency for Research on Cancer as possibly carcinogenic to humans (risk group 2b) (34).
In 2009 is het internationale Mobi-Kids onderzoek gestart, waar bij de relatie tussen factoren in de leefomgeving (waaronder mobiele telefonie) en het ontstaan van hersentumoren bij kinderen en jongvolwassenen wordt onderzocht. De resultaten van deze studie worden in 2015/2016 verwacht (www.mbkds.net).
Roken
Het is twijfelachtig of er een relatie bestaat tussen roken en het ontstaan van meningeomen. In één studie hebben mannen die roken een verhoogd risico op het ontwikkelen van een meningeoom (OR=2.1; 95%-betrouwbaarheidsinterval (95%BI):1,1-4,2) (35). Bij straling geïnduceerde meningeomen zou dit nog meer uitgesproken zijn (36). Een enkele studie meldt een verhoogd risico op een meningeoom bij zowel mannen als vrouwen door passief roken (35). Andere onderzoeken tonen echter geen verband aan tussen roken en de ontwikkeling van meningeomen (37) (38).
Exogene geslachthormonen
Het is twijfelachtig of het gebruik van exogene hormonen, zoals orale anticonceptie of postmenopauzale hormoontherapie, een risicofactor vormt voor het krijgen van een meningeoom. Zowel een verhoogd risico op een meningeoom, als het ontbreken daarvan, is bij gebruik van exogene hormonen beschreven (39) (40) (9).
Het gebruik van orale anticonceptie is mogelijk wel van invloed op de histologie van al bestaande meningeomen, waarbij vooral progestagenen het aantal progesteronreceptoren op het meningeoom kunnen verlagen (OR=3,2; 95% BI: 1,3-8,0) (38) (3).
In een grootschalig follow-up onderzoek (1,213,522 persoonsjaren) werden in totaal 125 meningeomen gevonden, waarbij er een verhoogd risico was op een meningeoom in drie groepen: premenopauzale vrouwen, postmenopauzale vrouwen die ooit hormoontherapie hadden gebruikt en postmenopauzale vrouwen die hormoontherapie gebruikten, allen ten opzichte van de groep vrouwen die nooit hormoontherapie had gebruikt (41). In een recente publicatie was een verhoogd relatief risico op een meningeoom te zien bij het gebruik van hoge dosis cyproterone acetaat (CPA) in een groep 2474 personen (30% mannen met prostaatcarcinoom en 70% vrouwen) (RR=11.4; 95% BI:4,3-30,8) (42). Het absolute risico op een meningeoom in de CPA groep was echter laag (n=4). Andere studies rapporteerden geen significant verband tussen hormoonsubstitutietherapie en meningeomen (3) (43) (7) (44). Er is tot nu toe geen associatie gevonden bij mannen tussen hormoongerelateerde factoren zoals orchiectomie en vasectomie en het voorkomen van intracraniële meningeomen (45).
Referenties
- 1 - Whittle IR, Smith C, Navoo P, Collie D. Meningiomas. Lancet 2004 May 8;363(9420):1535-1543.
- 2 - Campbell BA, Jhamb A, Maguire JA, Toyota B, Ma R. Meningiomas in 2009: controversies and future challenges. Am J Clin Oncol 2009 Feb;32(1):73-85.
- 3 - Custer B, Longstreth WT,Jr, Phillips LE, et al. Hormonal exposures and the risk of intracranial meningioma in women: a population-based case-control study. BMC Cancer 2006 Jun 7;6:152.
- 4 - Sioka C, Kyritsis AP. Chemotherapy, hormonal therapy, and immunotherapy for recurrent meningiomas. J Neurooncol. 2009 Mar;92(1):1-6.
- 5 - Cowppli-Bony A, Bouvier G, Rue M, et al. Brain tumors and hormonal factors: review of the epidemiological literature. Cancer Causes Control 2011 May;22(5):697-714.
- 6 - Malmer B, Tavelin B, Henriksson R, Gronberg H. Primary brain tumours as second primary: a novel association between meningioma and colorectal cancer. Int J Cancer 2000 Jan 1;85(1):78-81.
- 7 - Lee E, Grutsch J, Persky V, Glick R, Mendes J, Davis F. Association of meningioma with reproductive factors. Int J Cancer 2006 Sep 1;119(5):1152-1157.
- 8 - Wigertz A, Lonn S, Hall P, Auvinen A, Christensen HC, Johansen C, et al. Reproductive factors and risk of meningioma and glioma. Cancer Epidemiol Biomarkers Prev 2008 Oct;17(10):2663-2670.
- 9 - Michaud DS, Gallo V, Schlehofer B, Tjonneland A, Olsen A, Overvad K, et al. Reproductive factors and exogenous hormone use in relation to risk of glioma and meningioma in a large European cohort study. Cancer Epidemiol Biomarkers Prev 2010 Oct;19(10):2562-2569.
- 10 - Smith MJ, O'Sullivan J, Bhaskar SS, Hadfield KD, Poke G, Caird J, et al. Loss-of-function mutations in SMARCE1 cause an inherited disorder of multiple spinal meningiomas. Nat Genet 2013 Mar;45(3):295-298.
- 11 - Korhonen K, Salminen T, Raitanen J, Auvinen A, Isola J, Haapasalo H. Female predominance in meningiomas can not be explained by differences in progesterone, estrogen, or androgen receptor expression. J Neurooncol 2006 Oct;80(1):1-7.
- 12 - Hatch EE, Linet MS, Zhang J, Fine HA, Shapiro WR, Selker RG, et al. Reproductive and hormonal factors and risk of brain tumors in adult females. Int J Cancer 2005 May 1;114(5):797-805.
- 13 - Schlehofer B, Blettner M, Wahrendorf J. Association between brain tumors and menopausal status. J Natl Cancer Inst 1992 Sep 2;84(17):1346-1349.
- 14 - Custer BS, Koepsell TD, Mueller BA. The association between breast carcinoma and meningioma in women. Cancer 2002 Mar 15;94(6):1626-1635.
- 15 - Rao G, Giordano SH, Liu J, McCutcheon IE. The association of breast cancer and meningioma in men and women. Neurosurgery 2009 Sep;65(3):483-9; discussion 489.
- 16 - Claus EB, Bondy ML, Schildkraut JM, et al. Epidemiology of intracranial meningioma. Neurosurgery 2005 Dec;57(6):1088-95; discussion 1088-95.
- 17 - Hijiya N, Hudson MM, Lensing S, Zacher M, Onciu M, Behm FG, et al. Cumulative incidence of secondary neoplasms as a first event after childhood acute lymphoblastic leukemia. JAMA 2007 Mar 21;297(11):1207-1215.
- 18 - Shintani T, Hayakawa N, Hoshi M, Sumida M, Kurisu K, Oki S, et al. High incidence of meningioma among Hiroshima atomic bomb survivors. J Radiat Res 1999 Mar;40(1):49-57.
- 19 - Ron E, Modan B, Boice JD,Jr, Alfandary E, Stovall M, Chetrit A, et al. Tumors of the brain and nervous system after radiotherapy in childhood. N Engl J Med 1988 Oct 20;319(16):1033-1039.
- 20 - Harrison MJ, Wolfe DE, Lau TS, Mitnick RJ, Sachdev VP. Radiation-induced meningiomas: experience at the Mount Sinai Hospital and review of the literature. J Neurosurg 1991 Oct;75(4):564-574.
- 21 - Taylor AJ, Little MP, Winter DL, Sugden E, Ellison DW, Stiller CA, et al. Population-based risks of CNS tumors in survivors of childhood cancer: the British Childhood Cancer Survivor Study. J Clin Oncol 2010 Dec 20;28(36):5287-5293.
- 22 - Vinchon M, Leblond P, Caron S, Delestret I, Baroncini M, Coche B. Radiation-induced tumors in children irradiated for brain tumor: a longitudinal study. Childs Nerv Syst 2011 Mar;27(3):445-453.
- 23 - Strojan P, Popovic M, Jereb B. Secondary intracranial meningiomas after high-dose cranial irradiation: report of five cases and review of the literature. Int J Radiat Oncol Biol Phys 2000 Aug 1;48(1):65-73.
- 24 - Umansky F, Shoshan Y, Rosenthal G, Fraifeld S, Spektor S. Radiation-induced meningioma. Neurosurg Focus 2008;24(5):E7.
- 25 - Longstreth WT,Jr, Phillips LE, Drangsholt M, Koepsell TD, Custer BS, Gehrels JA, et al. Dental X-rays and the risk of intracranial meningioma: a population-based case-control study. Cancer 2004 Mar 1;100(5):1026-1034.
- 26 - Claus EB, Calvocoressi L, Bondy ML, et al. Dental x-rays and risk of meningioma. Cancer 2012 Sep 15;118(18):4530-7.
- 27 - Wrixon AD. New ICRP recommendations. J Radiol Prot 2008 Jun;28(2):161-168.
- 28 - Pearce MS, Salotti JA, Little MP, McHugh K, Lee C, Kim KP, et al. Radiation exposure from CT scans in childhood and subsequent risk of leukaemia and brain tumours: a retrospective cohort study. Lancet 2012 Aug 4;380(9840):499-505.
- 29 - Schuz J, Bohler E, Berg G, Schlehofer B, Hettinger I, Schlaefer K, et al. Cellular phones, cordless phones, and the risks of glioma and meningioma (Interphone Study Group, Germany). Am J Epidemiol 2006 Mar 15;163(6):512-520.
- 30 - Lahkola A, Salminen T, Raitanen J, Heinavaara S, Schoemaker MJ, Christensen HC, et al. Meningioma and mobile phone use--a collaborative case-control study in five North European countries. Int J Epidemiol 2008 Dec;37(6):1304-1313.
- 31 - Ahlbom A, Feychting M, Green A, Kheifets L, Savitz DA, Swerdlow AJ, et al. Epidemiologic evidence on mobile phones and tumor risk: a review. Epidemiology 2009 Sep;20(5):639-52.
- 32 - Carlberg M, Soderqvist F, Hansson Mild K, et al. Meningioma patients diagnosed 2007--2009 and the association with use of mobile and cordless phones: a case--control study. Environ Health 2013 Jul 19;12(1):60.
- 33 - Baan R, Grosse Y, Lauby-Secretan B, et al. Carcinogenicity of radiofrequency electromagnetic fields. Lancet Oncol 2011 Jul;12(7):624-6.
- 34 - IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Non-ionizing radiation, part 2: radiofrequency electromagnetic fields. Lyon: International Agency for Research on Cancer; 2013.
- 35 - Phillips LE, Longstreth WT,Jr, Koepsell T, Custer BS, Kukull WA, van Belle G. Active and passive cigarette smoking and risk of intracranial meningioma. Neuroepidemiology 2005;24(3):117-122.
- 36 - Flint-Richter P, Mandelzweig L, Oberman B, Sadetzki S. Possible interaction between ionizing radiation, smoking, and gender in the causation of meningioma. Neuro Oncol 2011 Mar;13(3):345-352.
- 37 - Schneider B, Pulhorn H, Rohrig B, Rainov NG. Predisposing conditions and risk factors for development of symptomatic meningioma in adults. Cancer Detect Prev 2005;29(5):440-447.
- 38 - Benson VS, Pirie K, Green J, et al, Million Women Study Collaborators. Lifestyle factors and primary glioma and meningioma tumours in the Million Women Study cohort. Br J Cancer 2008 Jul 8;99(1):185-90.
- 39 - Claus EB, Black PM, Bondy ML, et al. Exogenous hormone use and meningioma risk: what do we tell our patients? Cancer 2007 Aug 1;110(3):471-6.
- 40 - Korhonen K, Raitanen J, Isola J, Haapasalo H, Salminen T, Auvinen A. Exogenous sex hormone use and risk of meningioma: a population-based case-control study in Finland. Cancer Causes Control 2010 Dec;21(12):2149-2156.
- 41 - Jhawar BS, Fuchs CS, Colditz GA, Stampfer MJ. Sex steroid hormone exposures and risk for meningioma. J Neurosurg 2003 Nov;99(5):848-853.
- 42 - Gil M, Oliva B, Timoner J, Macia MA, Bryant V, de Abajo FJ. Risk of meningioma among users of high doses of cyproterone acetate as compared with the general population: evidence from a population-based cohort study. Br J Clin Pharmacol 2011 Dec;72(6):965-968.
- 43 - Hasseleid BF, Meling TR, Ronning P, Scheie D, Helseth E. Surgery for convexity meningioma: Simpson Grade I resection as the goal: clinical article. J Neurosurg 2012 Dec;117(6):999-1006.
- 44 - Smith JS, Quinones-Hinojosa A, Harmon-Smith M, Bollen AW, McDermott MW. Sex steroid and growth factor profile of a meningioma associated with pregnancy. Can J Neurol Sci 2005 Feb;32(1):122-127.
- 45 - Schildkraut JM, Calvocoressi L, Wang F, Wrensch M, Bondy ML, Wiemels JL, et al. Endogenous and exogenous hormone exposure and the risk of meningioma in men. J Neurosurg 2014 Apr;120(4):820-826.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 04-01-2015
Laatst geautoriseerd : 04-01-2015
Geplande herbeoordeling :
Voorwaarden voor revisie en beoordelingsfrequentie zijn vastgelegd in de richtlijn. De geldigheidstermijn voor de richtlijn (maximaal 5 jaar na vaststelling) wordt vanuit IKNL bewaakt.
Ook de Landelijke Werkgroep Neuro-Oncologie (LWNO) toetst jaarlijks de actualiteit van de richtlijn. Het bestuur van de landelijke werkgroep draagt de verantwoordelijkheid om de behoefte voor herziening van de huidige richtlijn bij de beroepsgroepen te peilen. Om verscheidene redenen kan actualisatie eerder dan beoogd nodig zijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. Als dat aan de orde is, verzoekt de LWNO de meest bij het desbetreffende onderwerp betrokken vereniging[en] de revisie te financieren, bijvoorbeeld door middel van een hierop gericht beroep op SKMS gelden. Uiterlijk in 2018 zal een nieuwe multidisciplinaire werkgroep worden geïnstalleerd om de richtlijn te reviseren.
Algemene gegevens
In 2011 heeft de Landelijke Werkgroep Neuro-Oncologie (LWNO) het Integraal Kankercentrum Nederland (IKNL) verzocht om een richtlijn Meningeoom te ontwikkelen. Naar aanleiding hiervan is een landelijke richtlijnwerkgroep Meningeoom opgericht. De multidisciplinaire werkgroep is in juli 2012 gestart met de ontwikkeling van de richtlijn Meningeoom. IKNL zorgde voor methodologische begeleiding en secretariële ondersteuning van het proces.
Naast de autoriserende verenigingen heb de volgende verenigingen ingestemd met de inhoud:
Nederlandse Vereniging van Meningeoom Patiënten (NVMP; per oktober 2013 deel van Patiëntenvereniging Cerebraal)
Patiëntenvereniging Cerebraal (via Leven met Kanker Beweging (voorheen NFK)
Doel en doelgroep
Doelstelling
De richtlijn is een document met aanbevelingen ter ondersteuning van de praktijkvoering van zorgverleners die betrokken zijn bij patiënten met een intracranieel meningeoom. De aanbevelingen zijn gebaseerd op een zo hoog mogelijke graad van wetenschappelijk bewijs en consensus binnen de werkgroepleden. De richtlijn biedt de gebruikers inzicht in het tot stand komen van de aanbevelingen. Uitgangspunt zijn de knelpunten die in de dagelijkse praktijk bij patiënten met een intracranieel meningeoom worden gesignaleerd.
Doel van de richtlijn
Het verbeteren van de kwaliteit van zorg voor volwassen patiënten met een meningeoom. De richtlijn behelst het traject van diagnostiek, behandeling, voorlichting en begeleiding van patiënten met een intracranieel meningeoom. De richtlijn beoogt hiermee de kwaliteit van de zorgverlening te verbeteren, het klinisch handelen meer te baseren op bewijs dan op ervaringen en meningen, de transparantie van keuze voor behandelingen te vergroten en de diversiteit van handelen door professionals te verminderen.
De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten en biedt aanknopingspunten voor transmurale afspraken of lokale protocollen ter bevordering van de implementatie.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, klinische besluitvorming, behandeling en begeleiding van patiënten met een intracranieel meningeoom, zoals neurologen, neurochirurgen, radiotherapeuten, (neuro)pathologen, (neuro)radiologen, klinisch genetici, revalidatieartsen, huisartsen, psychologen, neuro-oncologieverpleegkundigen en verpleegkundig specialisten.
Deze richtlijn is primair geschreven voor bovenstaande (groepen) professionals en daardoor mogelijk minder makkelijk leesbaar voor patiënten. KWF Kankerbestrijding geeft patiëntenbrochures uit, die gebaseerd zijn op door IKNL gepubliceerde richtlijnen. Zie voor meer patiënteninformatie de folder ‘Hersentumoren’ van KWF en de website www.hersentumor.nl.
Doelpopulatie
De doelpopulatie betreft patienten van 18 jaar en ouder met een intracranieel meningeoom.
Samenstelling werkgroep
Alle werkgroepleden zijn afgevaardigd namens een wetenschappelijke, beroeps- of patiëntenvereniging en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is getracht rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
De Nederlandse Vereniging van Meningeoompatiënten (NVMP; per oktober 2013 deel van Patiëntenvereniging Cerebraal)) is eveneens vertegenwoordigd door middel van afvaardiging van de voorzitter van de patiëntenvereniging, alsmede een ervaringsdeskundige vanuit de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK) afkomstig van Vereniging Cerebraal.
De volgende (para)medische disciplines zijn in de werkgroep vertegenwoordigd:
- neurologie
- neurochirurgie
- radiotherapie
- (neuro)pathologie
- neuroradiologie
- neuropsychologie
- revalidatie
- verpleegkunde
Leden van de werkgroep
- Mw. dr. D. Brandsma, neuroloog Nederlands Kanker Instituut / Antoni van Leeuwenhoekziekenhuis en Slotervaartziekenhuis, Amsterdam, voorzitter
- Mw. drs. N.D.B. Gilhuijs, (neuro)patholoog, Westfries Gasthuis, Hoorn
- Dhr. Prof.dr. R.J.M. Groen, neurochirurg, UMCG, Groningen
- Mw. drs. E.J.J. Habets, psycholoog, MC Haaglanden, Den Haag
- Mw. drs. P. Hoenderdaal, patiëntvertegenwoordiger Vereniging Cerebraal
- Mw. dr. A.A. Jacobi - Postma, neuroradioloog MUMC+, Maastricht
- Mw. dr. A. Mendez Romero, radiotherapeut-oncoloog, Erasmus MC, Rotterdam
- Dhr. drs. C.G.J.H. Niël, radiotherapeut-oncoloog, RISO, Deventer
- Mw.dr. S.M. Peerdeman, neurochirurg, VUmc, Amsterdam
- Mw. H. Petersen - Baltussen, nurse practitioner neurochirurgie, Radboud Universitair Medisch Centrum, Nijmegen
- Mw. drs. V.P.M. Schepers, revalidatiearts, UMCU, Utrecht
- Dhr. dr. T.J. Snijders, neuroloog, UMCU, Utrecht
- Dhr. H. van Valkenburg, patiëntvertegenwoordiger
- Dhr. Prof.dr. P. Wesseling, (neuro)patholoog Radboud Universitair Medisch Centrum, Nijmegen, VUmc, Amsterdam
- Mw. J.M.C. Zwinkels, verpleegkundig specialist NO, MC Haaglanden, Den Haag
Dhr. Dr. F.J. Hes, klinisch geneticus, Leids Universitair Medisch Centrum (LUMC), Leiden, heeft een bijdrage geleverd aan de tekst over genetische syndromen.
Ondersteuning
Medewerkers van het IKNL waren verantwoordelijk voor de procesbegeleiding en secretariële ondersteuning.
- Mw. drs. E.J.A Verhoof, procesbegeleider IKNL, locatie Utrecht
- Mw. M.L. van de Kar-van der Meulen, secretariële ondersteuning werkgroep Meningeoom, IKNL, locatie Utrecht
Literatuuronderzoek
Het literatuuronderzoek en het opstellen van de concept conclusies voor het evidence based gedeelte werd uitgevoerd door dr. J. Vlayen [Medical Evaluation & Technology Assessment, ME-TA, België], en mw. dr. L. Veerbeek [IKNL].
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke verenigingen.
Alle werkgroepleden hebben bij aanvang en bij de afronding van het richtlijn traject een belangenverklaring ingevuld. Hiermee geven de werkgroepleden aan onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Potentiële conflicterende belangen zijn door middel van ondervraging van de werkgroepleden opgespoord en besproken. De bevindingen zijn schriftelijke vastgelegd in de belangenverklaring en opvraagbaar via oncoline@iknl.nl.
Daarnaast is conceptrichtlijn ter becommentariëring aangeboden op www.oncoline.nl en aan alle voor de knelpuntenanalyse benaderde wetenschappelijke, beroeps- en patiëntenverenigingen. De werkgroep heeft het commentaar verwerkt waarna de richtlijn door alle relevante betrokken partijen is geautoriseerd
Inbreng patiëntenperspectief
Twee patiëntvertegenwoordigers namen zitting in de richtlijnwerkgroep (één ervaringsdeskundige op het gebied van meningeoom en één deskundige op het gebied van richtlijnontwikkeling). Bij de ontwikkeling van deze richtlijn is tijdens alle fasen gebruik gemaakt van de input van deze patiëntvertegenwoordigers. Deze input is nodig voor de ontwikkeling van een kwalitatief goede richtlijnen. Een goede behandeling voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt.
Door middel van onderstaande methoden is informatie verkregen en zijn de belangen van de patiënt meegenomen:
- Bij aanvang van het richtlijntraject is een patiëntenversie van de enquête voor het inventariseren van knelpunten in de zorg voor patiënten met een meningeoom uitgezet bij leden van de NVMP.
- Tijdens het richtlijntraject heeft een gesprek plaatsgevonden waarbij de patiëntvertegenwoordigers, de verpleegkundigen, de neuropsycholoog, de procesbegeleider en de voorzitter aanwezig waren om het patiëntenperspectief te inventariseren met behulp van het ICF-model. Het gesprek vond plaats ten tijde van het literatuuronderzoek van de evidence based uitgangsvragen. Hierdoor kon het patiëntperspectief worden meegenomen in de overige overwegingen bij het bespreken van de conclusies die volgden uit het literatuuronderzoek. De gestructureerde inventarisatie maakte de bijdrage vanuit het patiëntperspectief inzichtelijk en is vooral terug te vinden in de overige overwegingen en in de aanbevelingen.
- De NVMP en Vereniging Cerebraal zijn geconsulteerd in de externe commentaarronde.
Inventarisatie patiëntenperspectief middels het ICF-model
Het patiëntenperspectief is geïnventariseerd door de invloed van het hebben/hebben gehad van een meningeoom op het gehele leven, in al de dimensies van het ICF-model, te beschrijven.
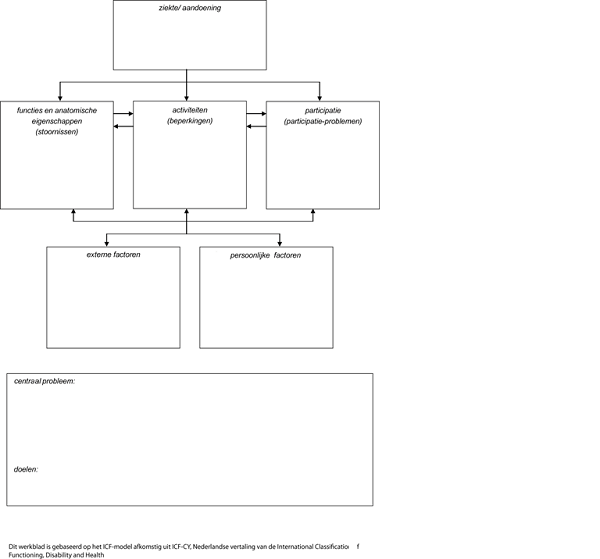
Ziekte/aandoening: mogelijkheden en beperkingen t.a.v.:
- Mentale functies
- Sensorische functies en pijn
- Stem en spraak
- Functies van hart en bloedvatenstelsel, hematologisch systeem, afweersysteem en ademhalingsstelsel
- Functies van spijsverteringsstelsel, metabool stelsel en hormoonstelsel
- Functies van urogenitaal stelsel en reproductieve functies
- Functies van bewegingssysteem en aan beweging verwante functies
- Functies van huid en verwante structuren
Mogelijkheden en beperkingen door de ziekte/aandoening voor patiënten met een meningeoom: medisch inhoudelijke zaken worden reeds in de richtlijn beschreven.
Functies en anatomische eigenschappen: mogelijkheden en beperkingen t.a.v.:
- Anatomische eigenschappen van zenuwstelsel
- Anatomische eigenschappen van oog, oor en verwante structuren
- Anatomische eigenschappen van structuren betrokken bij stem en spraak
- Anatomische eigenschappen van hart en bloedvatenstelsel, afweersysteem en ademhalingsstelsel
- Anatomische eigenschappen van spijsverteringsstelsel, metabool stelsel en hormoonstelsel
- Anatomische eigenschappen van urogenitaal stelsel
- Anatomische eigenschappen van structuren verwant aan beweging
- Anatomische eigenschappen van huid en verwante structuren
Mogelijkheden en beperkingen van functies en anatomische eigenschappen voor patiënten met een meningeoom:
- Epilepsie
- Vermoeidheid
- Cognitie
- Focale neurologische uitvalverschijnselen
- (Hoofd)Pijn
- Veranderingen van persoonlijkheid, emotie en gedrag
Activiteiten en participatie: mogelijkheden en beperkingen t.a.v.:
- Leren en toepassen van kennis
- Algemene taken en eisen
- Communicatie
- Mobiliteit
- Zelfverzorging
- Huishouden
- Tussenmenselijke interacties en relaties
- Belangrijke levensgebieden
- Maatschappelijk, sociaal en burgerlijk leven
Mogelijkheden en beperkingen van activiteiten en participatie voor patiënten met een meningeoom:
- Intermenselijke interactie en relaties
- Communicatie en mobiliteit
- Onderhouden van relaties
- Financiële afhankelijkheid
- Werkrelaties
- ADL
- Oudertaken
- Huishoudelijke taken
- Participatieproblemen
- Vrijetijdsbesteding
- Autorijden
- In een vliegtuig zitten
Externe factoren: mogelijkheden en beperkingen t.a.v.:
- Producten en technologie
- Natuurlijke omgeving en door de mens aangebrachte veranderingen daarin
- Ondersteuning en relaties
- Attitudes
- Diensten, systemen en beleid (bijv. binnen de maatschappij of gezondheidszorg)
Mogelijkheden en beperkingen van externe factoren voor patiënten met een meningeoom:
- Sociale omgeving
- Maatschappelijk functioneren
- Rol in gezin en relaties
- Beperkte toegankelijkheid van professionele hulp. Oorzaak hiervan is onvoldoende bekendheid met het aanbod en de beperkte vergoedingen van de verzekeraar
- Nazorgmogelijkheden voor partner zijn beperkt (i.v.m. vergoeding verzekeraar)
- UWV, Jobcoach
- Toegang tot nazorg/revalidatie is soms complex
De deelnemers aan de telefonische vergadering geven het volgende aan:
Wanneer er geen primaire revalidatie-indicatie is, is nazorg (te) beperkt, omdat de restverschijnselen niet gezien worden door zorgverleners. Met name de cognitieve beperkingen worden niet voldoende herkend. Screening gericht op cognitieve functies zouden hiervoor uitgevoerd moeten worden. Ook de patiënt en diens omgeving herkennen cognitieve dysfunctie pas op een later moment.
Na een half en een heel jaar postoperatief zou screening op cognitieve verschijnselen moeten plaatsvinden. Preoperatieve screening zou i.v.m. onderzoeksdoeleinden waardevol kunnen zijn. Een screeningsinstrument dat ingezet kan worden (als hulpmiddel): CLCE (niet gevalideerd). Het heeft mogelijk de voorkeur om een instrument te kiezen dat door de patiënt zelf wordt ingevuld, i.v.m. efficiëntie. Zorgverlener kan de patiënt daarnaast actief aanspreken om kritisch naar het eigen functioneren te kijken en de patiënt bewust te maken van eventuele uitvalsverschijnselen, om daar vervolgens passende ondersteuning/nazorg bij te bieden.
Persoonlijke factoren: mogelijkheden en beperkingen t.a.v.:
- factoren binnen het individu
Niet besproken
Patiëntenperspectief bij de vijf evidence based uitgangsvragen:
-
Bij het maken van een keuze voor de behandeling is rekening houden met wat de invloed is van het meningeoom op het functioneren. Ondanks dat er sprake is van een asymptomatisch meningeoom is het belangrijk te realiseren dat patiënten heel verschillend om kunnen gaan met het feit dat er een tumor in het hoofd is gediagnosticeerd. De patiënt moet een beeld geschetst worden wat de gevolgen zijn van wel/niet behandelen. De psychische gesteldheid moet worden meegewogen in de keuze voor het wel/niet behandelen.
-
De keuzes voor behandeling zijn vooral medisch ingegeven. De patiënt moet wel goed geïnformeerd worden over de gevolgen van therapie zoals chirurgie en radiotherapie. Er is weinig landelijk voorlichtingsmateriaal voor deze specifieke doelgroep beschikbaar. In de richtlijn kan opgenomen worden dat de patiënt bij het bespreken van het behandelplan een mantelzorger dient mee te nemen.
-
De keuze voor aanvullende radiotherapie is vooral medisch ingegeven. Omdat er sprake is van een lage bewijskracht, is het nut van aanvullende radiotherapie niet geheel duidelijk. Hierdoor is er mogelijk meer ruimte voor de wens van de patiënt bij het vaststellen van het behandelplan, echter zal de uiteindelijke keuze met name van de arts afhankelijk zijn en is het aan de arts de voor- en nadelen duidelijk te bespreken met de patiënt.
-
Een duidelijke uitleg moet gegeven worden over de wijze en frequentie van follow-up bij een meningeoom. De patiënt moet goed geïnstrueerd worden bij welke klachten met welke zorgverlener contact opgenomen moet worden. De zorgverlener moet in het gehele (na)zorgtraject expliciet aandacht hebben voor angst, onzekerheid en depressie en zorgdragen voor adequate doorverwijzing.
-
Herhaaldelijke screening op neuropsychologische klachten is wenselijk. Hoe en door wie deze screening plaats moet vinden kan per centrum bepaald worden. Op indicatie kan een neuropsychologisch onderzoek uitgevoerd worden. Neuropsychologisch onderzoek kan van waarde zijn bij begeleiding bij re-integratie in het arbeidsproces.
Methode ontwikkeling
Consensus based
Implementatie
Het bevorderen van het gebruik van de richtlijn begint met een brede verspreiding van de richtlijn. Er wordt een mailing verstuurd onder de professionals via de (wetenschappelijke) verenigingen en de werkgroepen van IKNL. Ook is de richtlijn gepubliceerd op www.oncoline.nl/richtlijn Intracranieel Meningeoom. Tevens zal er een artikel of manuscript ter publicatie aangeboden worden aan het Nederlands Tijdschrift voor Geneeskunde. Ook in andere tijdschriften of bij bijvoorbeeld nascholingsbijeenkomsten wordt de richtlijn onder de aandacht gebracht. Om het gebruik in de dagelijkse praktijk te bevorderen zal er een samenvattingskaart van de richtlijn gemaakt worden. Daarnaast beschikt IKNL over een toolbox ter ondersteuning van de IKNL adviseurs netwerken c.q. professionals in het veld voor de implementatie van de richtlijn. De toolbox bevat:
-
Een overzicht van de aanbevelingen.
-
De kernboodschappen (belangrijkste inhoudelijke boodschappen).
-
Een basis PowerPointpresentatie voor IKNL adviseurs netwerken en werkgroepleden van deze richtlijn.
-
Een implementatieplan voor deze richtlijn (incl. indicatoren voor evaluatie van de richtlijn). Dit plan bevat voor de belangrijkste aanbevelingen uit de richtlijn een overzicht van belemmerende en bevorderende factoren voor de implementatie. Op basis hiervan beschrijft het plan de belangrijkste doelgroepen en (adviezen voor) concrete acties om implementatie te bevorderen.
- Een training aan de IKNL adviseurs netwerken.
Werkwijze
Werkwijze
De richtlijnwerkgroep bestaat uit zorgverleners van verschillende (para)medische disciplines (bijlage 1). Ook twee patiëntvertegenwoordigers namen zitting in de richtlijnwerkgroep: één ervaringsdeskundige op het gebied van meningeoom en één deskundige op het gebied van richtlijnontwikkeling. Een overzicht van alle leden van de werkgroep is opgenomen in bijlage 2.
De werkgroep is op 11 juli 2012 voor de eerste maal bijeengekomen. Op basis van een eerste inventarisatie van de knelpunten door de werkgroepleden is, door middel van een enquête onder professionals die betrokken zijn bij patiënten met een meningeoom, een knelpunteninventarisatie gehouden. Na het versturen van de enquête hebben 168 professionals gerespondeerd en knelpunten geprioriteerd en/of ingebracht. De meest relevante knelpunten zijn uitgewerkt tot vijf uitgangsvragen (bijlage 11) die evidence based zijn uitgewerkt.
Voor iedere uitgangsvraag werd uit de richtlijnwerkgroep een subgroep geformeerd.
Bij de evidence based beantwoording van de vijf uitgangsvragen verzorgde een externe methodoloog het literatuuronderzoek, in overleg met de betreffende subgroep. Dit betrof het uitvoeren van een systematische literatuursearch, het kritisch beoordelen van de literatuur en het verwerken van de literatuur in evidence tabellen (bijlage 9). Daarnaast werd door de methodoloog een concept literatuurbespreking met bijbehorende conclusies aangeleverd voor deze uitgangsvragen. De werkgroepleden stelden overige overwegingen en aanbevelingen op volgens de checklist ‘overige overwegingen en formuleren van aanbevelingen’ (bijlage 7).
Voor de consensus-based delen in de richtlijn raadpleegden de werkgroepleden zelf de relevante bestaande literatuur. Op basis hiervan hebben de werkgroepleden de conclusies, overige overwegingen en aanbevelingen geformuleerd. Voor de consensus based beantwoording is geen systematisch literatuuronderzoek verricht en zijn de artikelen niet methodisch beoordeeld door een externe methodoloog.
De werkgroep heeft gedurende een periode van 18 maanden gewerkt aan de tekst van de conceptrichtlijn. Alle teksten zijn tijdens plenaire en telefonische vergaderingen besproken en na verwerking van de commentaren door de werkgroep geaccordeerd.
