GBS Klinimetrie
Uitgangsvraag
Welke meetinstrumenten kunnen worden geadviseerd voor de evaluatie van het effect van therapie bij het Guillain-Barré syndroom (GBS) in de verschillende fasen van de aandoening?
Aanbeveling
Voor het beoordelen van het effect van de therapie en het beloop van de ziekte in de verschillende fasen van GBS kan gebruik gemaakt worden van de ‘GBS disability’-schaal, de Rydel-Seiffer-stemvork, de INCAT sensory sumscore (ISS), een MRC-sumscore, de Martin Vigorimeter, de Fatigue Severity Scale (FSS), de Overall Disability Sum Score (ODSS), de Overall Neuropathy Limitations Scale (ONLS) en de Rotterdam 9-item Handicap Scale.
Overwegingen
Ondanks eerder genoemd onderzoek is er nog onvoldoende duidelijkheid welke meetinstrumenten bij voorkeur gebruikt moeten worden bij patiënten met GBS. Vanuit twee workshops over meetinstrumenten, geleid vanuit het ‘European Neuromuscular Centre’ (ENMC), werd een aantal aanbevelingen gedaan over wat verder nodig is voor de wetenschappelijke evaluatie en standaardisatie van meetinstrumenten voor toekomstige studies bij deze patiënten. Algemene consensus voor het gebruik van een minimumset van uitkomstmaten bij deze aandoening werd aanbevolen. Op deze consensusmeetings werden de AMC Linear Disability Score (ALDS), de Activity limitation (ACTIVLIM) en de EuroQol genoemd als mogelijk interessante meetinstrumenten voor gebruik bij patiënten met GBS (Merkies e.a., 2006; Lunn e.a., 2008). De ALDS en de ACTIVLIM zijn beide moderne lineair gewogen ‘disability’-schalen die het mogelijk maken om de functionele status van een patiënt met een chronische aandoening (ALDS) of een neuromusculaire ziekte in het algemeen (ACTIVLIM) te kwantificeren (Holman, 2004; Holman, 2005; Vandervelde, 2007). Omdat deze twee schalen niet ziektespecifiek zijn, is het niet zeker dat ze ook bruikbaar zijn bij patiënten met immuungemedieerde neuropathieën, in het bijzonder bij patiënten met GBS. Een meetinstrument dat naast de SF-36 mogelijk geschikt is voor meting van de gezondheidsgerelateerde kwaliteit van leven is de EuroQol (The EuroQol Group, 1990).
Gebaseerd op deze aanbevelingen is de Peripheral Neuropathy Outcome Measures Standardization (Perinoms) studie opgezet (zie onder). Het doel is de klinimetrische kennis verder te vergroten over de verschillende meetinstrumenten binnen alle domeinen van de ICF om uiteindelijk een specifieke minimumset van meetinstrumenten voor gebruik in toekomstig klinisch onderzoek bij patiënten met een inflammatoire polyneuropathie te kunnen presenteren. Het onderzoek wordt momenteel uitgevoerd in een samenwerkingsverband tussen enkele Nederlandse, Europese en Amerikaanse centra met ruime ervaring in de diagnostiek en behandeling van patiënten met inflammatoire neurologische aandoeningen (van Nes, 2008).
Rasch-methodiek en de Item-Response-theorie (ITR)
Een relatief nieuwe methode om vragenlijsten te optimaliseren op hun klinimetrische waarden zijn de Rasch-methodiek en de Item-Response-theorie (ITR). Dit zijn technieken die ordinale data, die vaak schaalafhankelijk zijn, kunnen transformeren naar interval(lineaire)-maten die schaalonafhankelijk zijn. Zij zijn beter geschikt om de relatie tussen de ernst van een ziektebeeld van de individuele patiënt en de zwaarte van een uit te voeren opdracht (zie figuur) te meten. De op deze wijze verkregen uitkomstmaten zijn een absolute aanvulling op de klassieke klinimetrische eigenschappen van meetinstrumenten zoals validiteit, betrouwbaarheid en responsiviteit. Meetinstrumenten die zijn geconstrueerd op basis van deze genoemde technieken (onder andere de Rasch-built Overall Disability Scale (R-ODS) - waarschijnlijk eind 2010 beschikbaar) worden momenteel voor het eerst in het Perinoms-onderzoek gebruikt bij patiënten met GBS en zullen in de nabije toekomst met grote waarschijnlijkheid in de neuromusculaire wereld geïmplementeerd worden.
Figuur 1
Rangschikken van op Rasch- of IRT-gebaseerde uitkomstmaten voor de relatie tussen ziekteactiviteit (mate waarin de patiënt aangedaan is) en moeilijkheid van een uit te voeren opdracht.
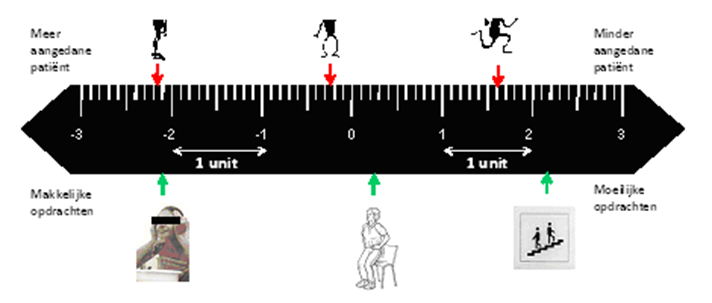
Gezicht wassen Opstaan uit stoel Traplopen
Op basis van een vragenlijst met oplopende moeilijkheidsgraad wordt gevraagd wat de patiënt op een bepaald moment kan (hier hoort een corresponderende waarde bij). Hierdoor wordt het mogelijk om de relatie tussen ernst van de ziekte van de individuele patiënt te correleren aan de zwaarte van een uit te voeren opdracht. Op deze wijze kan een verandering in de ernst van het ziektebeeld relatief eenvoudig en betrouwbaar worden gemeten.
Onderbouwing
Achtergrond
De term ‘klinimetrie’ werd geïntroduceerd door Feinstein (1987). Met deze term wordt bedoeld het op wetenschappelijke wijze vastleggen van klinische verschijnselen van een ziekte. Hiertoe wordt gebruik gemaakt van meetinstrumenten in de vorm van vragenlijsten of testen. Aan uitkomstmaten worden eisen gesteld. Zo moeten ze nauwkeurig zijn (valide: meten wat ze willen meten), betrouwbaar (metingen moeten dezelfde resultaten opleveren bij herhaling) en relevante veranderingen in de tijd meten (responsief). Daarnaast moeten ze bij voorkeur eenvoudig toepasbaar zijn, geschikt voor de doelgroep en indien mogelijk weinig tijd vergen waardoor de kans groter is dat ze ook in de praktijk gebruikt gaan worden.
Meetinstrumenten kunnen conform de International Classification of Functioning, Disability and Health (ICF)-terminologie van de World Health Organization worden ingedeeld naar het niveau waarop wordt gemeten: lichaamsfuncties en lichaamsstructuren, activiteiten en participatie (WHO, 2001). Daarnaast zijn er meetinstrumenten die de ervaren gezondheidgerelateerde kwaliteit van leven meten. De meetniveaus van de ICF en kwaliteit van leven zijn de basis geweest voor de European Inflammatory Neuropathy Cause and Treatment Group (INCAT) om tot consensus te komen over het gebruik van evaluatieve meetinstrumenten bij patiënten met GBS en CIDP. De INCAT is een internationale groep van neurologen die sinds 1998 verschillende artikelen hebben gepubliceerd over de keuze van meetinstrumenten en het vaststellen van hun klinimetrische eigenschappen bij patiënten met GBS en CIDP. Mede omdat er weinig literatuur is van andere groepen op dit specifieke gebied bij GBS is er voor de beantwoording van de vraag over klinimetrie voornamelijk gebruik gemaakt van de gepubliceerde literatuur vanuit de INCAT-studiegroep.
Voor de meetinstrumenten betreffende de prognose wordt verwezen naar module ‘Prognose’. Voor meetinstrumenten voor de ademhalingsfunctie en pijn, wordt verwezen naar module ‘Monitoring in de progressieve fase’ en Pijn’.
Conclusies
|
Niveau 3 |
Het is aannemelijk dat de Rydel-Seiffer-stemvork en de INCAT sensory sumscore (ISS) geschikt zijn om op lichaamsfunctieniveau gevoelsstoornissen te meten bij patiënten met GBS.
C Merkies 2000, Merkies 2000 |
|
Niveau 3 |
Het is aannemelijk dat de MRC-sumscore en de Martin Vigorimeter geschikt zijn om op lichaamsfunctieniveau de spierkracht en de handknijpkracht te meten bij patiënten met GBS.
C Merkies 2000 |
|
Niveau 3 |
Het is aannemelijk dat de Fatigue Severity Scale (FSS) geschikt is om de ervaren vermoeidheid te meten bij patiënten met GBS.
C Merkies, 2002 |
|
Niveau 3 |
Het is aannemelijk dat de Overall Disability Sum Score (ODSS) en de Overall Neuropathy Limitations Scale (ONLS) geschikte meetinstrumenten zijn om activiteiten te meten bij patiënten met GBS.
C Merkies 2002, Graham 2006 |
|
Niveau 3 |
Het is aannemelijk dat de Rotterdam 9-item Handicap Scale geschikt is om participatie te meten bij patiënten met GBS.
C Merkies 2002 |
Samenvatting literatuur
Een groot deel van de geselecteerde INCAT-studies betreft evaluaties van meetinstrumenten bij een groep Nederlandse patiënten. Omdat de evaluaties voornamelijk gebaseerd zijn op deze bronpopulatie wordt deze groep nader omschreven. De groep patiënten (n=133) bestaat uit personen van wie de gegevens zijn opgenomen in de ErasmusMC-databank voor patiënten met een immuungemedieerde polyneuropathie en uit personen die deelnamen aan de Nederlandse GBS-studie. De groep van 133 patiënten was samengesteld uit 113 stabiele patiënten met restverschijnselen bij wie de ziekte zich gemiddeld ruim vijf jaar voordien openbaarde. Deze stabiele groep patiënten werd cross-sectioneel beoordeeld (tweemaal in een periode van twee tot vier weken); voorts was er een groep van twintig patiënten bij wie de ziekte recent gediagnosticeerd werd en die longitudinaal gevolgd werd gedurende een periode van één jaar. De groep van 113 stabiele patiënten bestond uit 83 patiënten met GBS, 22 patiënten met een chronisch inflammatoire demyeliniserende polyneuropathie (CIDP) en acht patiënten met een monoclonal gammopathy of undetermined significance (MGUSP); 59 patiënten waren man en 54 vrouw; de gemiddelde leeftijd was 56 jaar (range: 14 tot 84 jaar). Negen CIDP-patiënten waren stabiel onder intervalbehandeling met intraveneus immuunglobuline (IVIg). De longitudinaal gevolgde groep bestond uit zeven GBS en dertien CIDP patiënten (twaalf mannen en acht vrouwen (gemiddelde leeftijd 54 jaar; range 15-70). In eerste instantie waren vier van hen gebonden aan bed en negen patiënten waren niet bedlegerig maar konden (nog) niet zelfstandig lopen. Hoewel de onderzochte groepen dus niet uit alleen patiënten met GBS bestonden en er geen aparte groepsresultaten beschreven zijn, heeft de werkgroep er toch voor gekozen om voor de beantwoording van de vraag uit te gaan van deze studies omdat dit momenteel de best beschikbare gegevens zijn afkomstig van patiënten met een immuungemedieerde neuropathie, overwegend bestaande uit GBS- en CIDP-patiënten.
De volgende meetinstrumenten werden in de bovengenoemde patiëntengroepen geëvalueerd:
|
Domein |
Meetinstrument (ref) |
|
ICF: lichaamsfuncties |
MRC-sumscore (Merkies, 2003a) Martin handheld-Vigorimeter (Merkies, 2000a, 2003a) INCAT Sensory Sum Score (Merkies, 2000b, 2003a) Rydel-Seiffer-stemvork (Merkies, 2000c) Fatigue Severity Scale (Merkies, 1999; van Nes e.a., 2009) |
|
ICF: activiteiten |
Overall Disability Sum Score (Merkies, 2002a, 2003a) Overall Neuropathy Limitations Scale (Graham, 2006a) |
|
ICF: participatie |
Rotterdam 9-items Handicap Scale (Merkies, 2002b) |
|
Kwaliteit van leven |
Short Form-36 (Merkies, 2002c) |
In mindere mate, meer ter vergelijking met bovengenoemde meetinstrumenten, werden ook de Modified Rankin scale, de tienmeterlooptest, de ‘Nine-Hole Peg Test” (Merkies e.a., 2003a), alsmede de ‘GBS disability scale’ (‘f-score’; zie bijlage Beoordelingsschalen) onderzocht. Bij de tienmeterlooptest en de ‘Nine-Hol Peg Test’ werd bij GBS- en CIDP-patiënten een matige responsiviteit vastgesteld (Merkies e.a., 2003a).
De MRC-sumscore is een maat voor de spierkracht en is op een eenvoudige wijze te scoren. De MRC-sumscore is een summatie van de spierkracht (in MRC-graad variërend van 0-5) van zes spiergroepen aan weerszijden van het lichaam. De spiergroepen die volgens de MRC-gradering zijn getest zijn de m. deltoïdeus, m. biceps brachi, de polsextensoren, m. iliopsoas, m. quadriceps en de voetheffers. De sumscore varieert van 0 (paralyse) tot 60 (maximale spierkracht). De MRC-sumscore is betrouwbaar te meten (Kleijweg, 1991) en is na onderzoek ook responsief gebleken (Merkies, 2003a).
De Martin handheld-Vigorimeter wordt gebruikt om de handknijpkracht te meten (Merkies, 2000a). Handknijpkracht geeft een indicatie van de distale kracht en het functioneren van de bovenste extremiteiten. In een groep van 530 gezonde vrijwilligers werden normaalwaarden bepaald en onderverdeeld naar tienjaarsleeftijdsklassen en geslacht (Merkies, 1998). De test werd ook afgenomen bij de 133 patiënten. In de groep patiënten werd naast de test met de Vigorimeter ook de ‘arm disability scale' (ADS) als onderdeel van de ODSS, afgenomen. Er werd een redelijk tot goede correlatie gevonden tussen de handknijpkrachtwaarden en de waarden op de ADS. De intra- en interwaarnemerovereenkomsten waren hoog voor de Vigorimeter en ook de responsiviteit was goed (Merkies e.a., 2003a).
De INCAT Sensory Sum Score (ISS), bestaande uit eenvoudige metingen van de pijnzin, de vibratiezin en de tweepuntsdiscriminatie, werd samengesteld na een systematische review van de literatuur naar sensorische testen bij patiënten met een immuungemedieerde polyneuropathie en na consultering van een panel van Europese neurologen (Merkies, 2000b). De validiteit van de ISS werd bepaald aan de hand van de correlatie met de ‘Nine-Hole Peg Test’, een tienmeterlooptest en de ODSS. De ISS correleerde in de stabiele groep redelijk met de andere schalen. Dit werd ook gevonden in de longitudinale groep, behalve voor de tienmeterlooptest. De intra- en interwaarnemerovereenkomsten bleken goed. Ook de interne consistentie was goed (in de groep stabiele patiënten circa 0,7 en in de groep patiënten die longitudinaal bestudeerd werd 0,87). Gedurende de follow-up in de longitudinale groep namen de waarden op de ISS, zoals verwacht, af.
Bovendien was er een significant verband tussen de waarden op de ISS en het eigen oordeel van de patiënt (heuristische responsiviteit). De ISS is ook responsief gebleken (Merkies, 2003a).
De Rydel-Seiffer-stemvork is voorzien van een schaalverdeling voor kwantitatieve meting van de vibratiezin waarbij trillingen met een verschillende intensiteit onderscheiden kunnen worden. Er zijn leeftijdsafhankelijke normaalwaarden verkregen (Merkies, 1998). De betrouwbaarheid en responsiviteit van deze stemvork werd getest in bovenbeschreven groep van 133 patiënten (Merkies e.a., 2000c). Hiertoe werd de test driemaal uitgevoerd van distaal naar proximaal aan armen en benen. Vervolgens werd de gemiddelde waarde bepaald waarbij de trillingen niet meer werden waargenomen. Deze waarde werd vergeleken met de gepubliceerde normaalwaarden en gegradeerd van 0 (geen afwijkingen) tot 8 (vibraties onvoldoende waargenomen tot aan het acromioclaviculair gewricht en de spina iliaca anterior superior). De betrouwbaarheid van herhaalde metingen door dezelfde waarnemer maar ook tussen waarnemers was goed. Verbetering in de longitudinale groep (n=20) ging gepaard met een afname in de score. Dit houdt in dat de responsiviteit van de test in deze patiëntengroep goed is.
De Fatigue Severity Scale (FSS) is een korte, eenvoudige vragenlijst bestaande uit negen items waarbij de antwoorden voor iedere vraag variëren van 1 (‘sterk mee oneens’) tot 7 (‘sterk mee eens’) (Merkies, 1999). Recent werd de oorspronkelijke FSS aangepast voor gebruik bij patiënten met een immuun-gemedieerde polyneuropathie door de Rasch-methodiek (van Nes e.a., 2009) te gebruiken (zie ook overige overwegingen). Deze gemodificeerde en hiermee ook vereenvoudigde FSS bestaat uit zeven in plaats van negen vragen, met vier in plaats van zeven keuzemogelijkheden. Deze gemodificeerde FSS bleek een goede betrouwbaarheid en validiteit te hebben.
De Overall Disability Sum Score (ODSS) is een korte vragenlijst naar de functionele beperkingen gerelateerd aan de armen en benen. De validiteit, betrouwbaarheid en responsiviteit van de ODSS bleken goed en er werd een significante associatie met de andere meetmethoden (MRC-sumscore, ISS, handknijpkracht en Modified Rankin scale) gevonden (Merkies, 2002a). De ODSS is ook responsief gebleken (Merkies, 2003a). Er is inmiddels een Raschversie van de ODSS (Rasch-ODSS), (Van Nes, in press).
De Overall Neuropathy Limitations Scale (ONLS) is een beoordelingsschaal die is ontwikkeld op basis van de ODSS. De verandering bestaat hoofdzakelijk uit het toevoegen van een vraag of de patiënt in staat is om trap te lopen en om hard te lopen. De ONLS heeft een wat betere content-validiteit en wat minder ceiling-effect in vergelijking met de ODSS.
De responsiviteit bij een groep patiënten die niet louter uit GBS- en CIDP-patiënten bestond was redelijk (standardised response mean 0,76) (Graham, 2006a).
Voor de Rotterdam ‘9-items Handicap Scale’ werden door middel van een literatuurreview mogelijke items gezocht (Merkies, 2002b). Vervolgens werd via telefonische interviews en mail bij vijftig patiënten (zogenaamde ‘focusgroep’) nagegaan welke items relevant waren. Daarna werd een voorlopige versie van de schaal voorgelegd aan een internationale groep van dertien neurologen. De definitieve set van negen items werd ten slotte getest in de eerdergenoemde patiëntengroep. Naast de Rotterdam ‘9-items Handicap Scale’ werden ook de ‘Modified Rankin scale’ en de ‘GBS disability scale’ afgenomen. De Rotterdam 9-items handicapschaal bleek makkelijk en snel uitvoerbaar. De validiteit, betrouwbaarheid en responsiviteit waren goed. De schaal bleek een duidelijk onderscheid te kunnen maken tussen verschillende graden van ernst van de ziekte.
Door middel van de SF-36 kan een indruk worden gekregen van de ervaren kwaliteit van leven, gemeten op diverse domeinen. De SF-36, een frequent toegepaste test bij andere ziektebeelden, werd getest op zijn bruikbaarheid bij patiënten met immuungemedieerde polyneuropathie (Merkies, 2002c). Zowel de gemiddelde scores op de diverse domeinen als op de mentale en fysieke totaalscore bleken significant lager voor de patiëntengroep ten opzichte van de normaalwaarden in de Nederlandse bevolking, waarbij de fysieke onderdelen het meest aangedaan zijn. Er werd een goede interne consistentie gevonden en een redelijk tot goede responsiviteit. De correlatie met andere schalen was matig tot goed waarbij de hoogste associatie gevonden werd voor de fysiek georiënteerde items van de SF-36 met de MRC-sumscore. Geconcludeerd werd dat de SF-36 een waardevol instrument zou kunnen zijn voor het meten van kwaliteit van leven bij patiënten met een immuungemedieerde polyneuropathie.
Bovengenoemde meetinstrumenten zijn gebruikt in een onderzoek onder de al eerder genoemde 113 stabiele patiënten om na te gaan of er een verband bestaat tussen de meetinstrumenten die een functie, een activiteit en participatie meten (Merkies, 2003b). De testen die werden gebruikt voor het meten van functies waren: de FSS, de MRC-sumscore, de ISS en de Vigorimeter. Op activiteitenniveau werden afgenomen: de ‘Nine-Hole Peg Test’, de tienmeterlooptest, de ODSS, de ‘GBS disability scale’ en de Modified Rankin scale. Ten slotte werd ook de ‘Rotterdam 9-items Handicap Scale’ afgenomen voor het meten van de participatie. Bijna tweederde van de scores op activiteitenniveau kon verklaard worden door de scores op functieniveau
(met uitzondering van vermoeidheid). De meetinstrumenten voor activiteitenmeting verklaarden op hun beurt 76% van de variatie in de scores op participatieniveau, waarbij echter de ‘Nine-Hole Peg Test’ en de ‘GBS-disability scale’-scores geen toegevoegde waarde bleken te hebben. De scores op de Modified Rankin scale, ODSS, tienmeterlooptest en FSS verklaarden voor 77% de variatie in participatiescores (gemeten op de ‘Rotterdam 9-items Handicap Scale’).
De invloed van vermoeidheid werd ook onderzocht met de FSS bij 113 patiënten met immuungemedieerde polyneuropathieën (Merkies et al. Neurology 1999;53:1648-54). Ernstige vermoeidheid (FSS scores > 95e percentiel bij controles, wat overeenkomt met een FSS > 5.0) werd gevonden in een hoog percentage (80%) van deze patiënten en bleek een ernstig invaliderend symptoom te zijn. Vermoeidheid bleek op zichzelf te staan en geen relatie te hebben met zwakte, gevoelsstoornissen of duur van de ziekte. Bij patiënten met GBS bleek vermoeidheid gerelateerd te zijn aan psychosociale domeinen van de SF-36. In tegenstelling tot deze bevindingen bleek vermoeidheid bij patiënten met een chronische polyneuropathie (CIDP of MGUSP) eerder een relatie te hebben met de meer fysiek georiënteerde domeinen van de SF-36. Vanuit deze bevindingen werd verondersteld dat patiënten met GBS de klap van het snel ontwikkelen van neurologische verschijnselen waarschijnlijk moeizaam te boven komen, terwijl de patiënten met chronische verschijnselen meer gebukt gaan onder de dreiging van verdere fysieke achteruitgang, waardoor zij meer geneigd zouden zijn om klachten zoals vermoeidheid te relateren aan het fysieke lijden.
Referenties
- Feinstein AR. Clinimetrics. Yale University Press, New Haven. 1987;pp 1-5.
- Graham RC, Hughes RA. A modified peripheral neuropathy scale: the Overall Neuropathy Limitations Scale. J Neurol Neurosurg Psychiatry 2006;77(8):973-6. [a]
- Graham RC, Hughes RAC. Clinimetric properties of a walking scale in peripheral neuropathy. J Neurol Neurosurg Psychiatry 2006;77:977-979. [b]
- Holman R, Lindeboom R, Vermeulen M, de Haan RJ. The AMC Linear Disability Score project in a population requiring residential care: psychometric properties. Health Qual Life Outcomes 2004;2:42.
- Holman R, Weisscher N, Glas CA, et al. The Academic Medical Center Linear Disability Score (ALDS) item bank: item response theory analysis in a mixed patient population. Health Qual Life Outcomes 2005;3:83.
- Kleyweg RP, van der Meché FG, Schmitz PI. Interobserver agreement in the assessment of muscle strength and functional abilities in Guillain-Barré syndrome. Muscle Nerve 1991;14(11):1103-9.
- Lunn MP, Léger JM, Merkies IS, Van den Bergh P, van Schaik IN; Inflammatory Neuropathy Consortium; ENMC. 151st ENMC international workshop: Inflammatory Neuropathy Consortium 13th-15th April 2007, Schiphol, The Netherlands. Neuromuscul Disord 2008;18(1):85-9.
- Martina, I.S.J., van Koningsveld R, Schmitz P.I.M., van der Meche F.G.A., van Doorn P.A. for the Inflammatory Neuropathy Cause and Treatment (INCAT) Group J Neurol Neurosurg Psychiatry 1998;65:743-747.
- Merkies IS, Schmitz PI, Samijn JP, van der Meché FG, van Doorn PA. Fatigue in immune-mediated polyneuropathies. European Inflammatory Neuropathy Cause and Treatment (INCAT) Group. Neurology 1999;53(8):1648-54.
- Merkies IS, Schmitz PI, Samijn JP, Meche FG, Toyka KV, Van Doorn PA, et al. Assessing grip strength in healthy individuals and patients with immune-mediated polyneuropathies. Muscle Nerve 2000; 23(9):1393-1401. [a]
- Merkies ISJ, Schmitz PIM, Van Der Meche FG, Van Doorn PA. Psychometric evaluation of a new sensory scale in immune-mediated polyneuropathies. Neurology 2000;54(4):943-949. [b]
- Merkies ISJ, Schmitz PIM, Van Der Meche FG, Van Doorn PA. Reliability and responsiveness of a graduated tuning fork in immune mediated polyneuropathies. J Neurol Neurosurg Psychiatry 2000;68:669-67. [c]
- Merkies IS, Schmitz PI, Van Der Meche FG, Samijn JP, Van Doorn PA. Inflammatory Neuropathy Cause and Treatment (INCAT) Group., et al. Clinimetric evaluation of a new overall disability scale in immune mediated polyneuropathies. J Neurol Neurosurg Psychiatry 2002; 72(5):596-601. [a]
- Merkies ISJ, Schmitz PIM, Van Der Meche FG, Samijn JP, Van Doorn PA. Psychometric evaluation of a new handicap scale in immune-mediated polyneuropathies. Muscle Nerve 2002; 25:370-377. [b]
- Merkies IS, Schmitz PI, Van Der Meche FG, Samijn JP, Van Doorn PA. Inflammatory Neuropathy Cause and Treatment (INCAT) Group., et al. Quality of life complements traditional outcome measures in immune-mediated polyneuropathies. Neurology 2002;59(1):84-91. [c]
- Merkies IS, Schmitz PI, Van Der Meché FG, Van Doorn PA. Comparison between impairment and disability scales in immune-mediated polyneuropathies. Muscle Nerve 2003;28:93-100. [a]
- Merkies IS, Schmitz PI, Van Der Meche FG, Samijn JP, Van Doorn PA. Inflammatory Neuropathy Cause and Treatment (INCAT) Group., et al. Connecting impairment, disability, and handicap in immune mediated polyneuropathies. J Neurol Neurosurg Psychiatry 2003;74(1):99-104. [b]
- Merkies IS, Lauria G. 131st ENMC international workshop: selection of outcome measures for peripheral neuropathy clinical trials 10-12 December 2004, Naarden, The Netherlands. Neuromuscul Disord 2006;16(2):149-56.
- The EuroQol group. EuroQol: a new facility for the measurement of health-related quality of life. Health Policy 1990;16:199-208.
- Vandervelde L, Van den Bergh PY, Goemans N, Thonnard JL. ACTIVLIM: a Rasch-built measure of activity limitations in children and adults with neuromuscular disorders. Neuromuscul Disord 2007;17:459-469.
- Van Nes SI, Faber CG, Merkies IS. Outcome measures in immune- mediated neuropathies: the need to standardize their use and to understand the clinimetric essentials. J Peripher Nerv Syst. 2008;13:136-147.
- Van Nes SI, Vanhoutte EK, Faber CG, Garssen M, van Doorn PA, Merkies IS; PeriNomS Study Group. Improving fatigue assessment in immune-mediated neuropathies: the modified Rasch-built fatigue severity scale. J Peripher Nerv Syst 2009;14:268-278.
- Van Nes SI et al. Rasch-built Overall Disability Scale (R-ODS) for immune-mediated peripheral neuropathies. Neurology, in press.
- World Health Organization. International classification of functioning, disability and health: ICF. Geneva, 2001.
Evidence tabellen
Bewijsklassetabel Klinimetrie
|
Auteur, jaartal |
Mate van bewijs |
Studie type |
Populatie |
Inclusiecriteria |
Eindpunt |
Interventie |
Controle |
Resultaat |
Opmerkingen |
|
Merkies, 2002 |
C |
deels cross-sectioneel, deels prospectief 8 artsen (w.o. 2 neurologen) namen in wisselende koppels de testen af (elke patiënt werd 2x onderzocht). De pas gediagnosticeerde patiënten werden 11x onderzocht in een jaar. |
N=133 (allen uit Rotterdamse immuungemedieerde polyneuropathie databank of de NL GBS-studie); 113 stabiele patiënten (83 GBS, 22 CIDP, 8 MGUSP) met een mediane duur van symptomen van 5,1 jaar en 20 patiënten met recent gediagnosticeerde GBS (n=7) of CIDP (n=13). |
Internationale ziektecriteria |
validiteit, betrouwbaarheid en “responsiviteit” van de “overall disability sum score (ODSS)” |
ODSS |
MRC sum score, “Incat” sensory sum score, Vigorimeter (handknijpkracht), Hughes functional grading scale en Rankin scale |
significante validiteit en goede betrouwbaarheid significante associatie met de andere meetmethoden |
|
|
Merkies, 2003 |
C |
|
N=133 (allen uit Rotterdamse immuungemedieerde polyneuropathie databank of de NL GBS-studie) ; 113 stabiele patiënten (83 GBS, 22 CIDP, 8 MGUSP) met een mediane duur van symptomen van 6,9 jaar en 20 patiënten met recent gediagnosticeerde GBS (n=7) of CIDP (n=13). |
Internationale ziektecriteria |
Doel van de studie: evalueren van een mogelijk verband tussen impairment, disability en handicap. Bovendien bepalen van het deel van de variatie in handicap dat verklaard wordt door de gecombineerde metingen van impairment en disability. |
MRC sum score, “Incat” sensory sum score, Vigorimeter (handknijpkracht), Hughes functional grading scale, Rankin scale, ODSS, NL versie van de “fatigue severity scale (FSS)”, “nine hole peg test”, 10-meter looptest en de Rotterdam 9 items handicap schaal. |
|
2 point discrimination test was sterkst verklarend bij gevoels stoornissen. ca. 1/3e van de handicap verklaard door MRC sum score en handknijpkracht afzonderlijk. Lagere maar wel sign. associatie tussen ISS en RIHS9. ODSS sterkste verklarende variabele van handicap (65% van de variatie in RIHS9-waarden).
Ca. 2/3e van disability verklaard door impairment-measures (muv. vermoeidheid). 76% van disturbances door handicap werden verklaard door disability-measures. Model met Rankin, ODSS, 10-meter looptest en FSS verklaarde 77% van de variatie in handicap-scores.
|
|
|
Merkies, 2002 |
|
deels cross-sectioneel, deels prospectief 8 artsen (w.o. 2 neurologen) namen in wisselende koppels de testen af (elke patiënt werd 2x onderzocht). De pas gediagnosticeerde patiënten werden 11x onderzocht in een jaar. |
N=133 (allen uit Rotterdamse immuungemedieerde polyneuropathie databank of de NL GBS-studie); 113 stabiele patiënten (83 GBS, 22 CIDP, 8 MGUSP) met een mediane duur van symptomen van 5,1 jaar en 20 patiënten met recent gediagnosticeerde GBS (n=7) of CIDP (n=13). |
Internationale ziektecriteria |
Doel: ontwikkeling en evaluatie van een nieuwe handicap-schaal (de Rotterdam-9-items handicap schaal). Items geselecteerd uit literatuur. Per telefoon of email voorgelegd aan patiënten. Verkregen info gebruikt voor 1e versie van de schaal; voorgelegd aan groep van 13 neurologen (leden van de Inflammatory Neuropathy Cause and Treatment group). N.a.v. commentaren aangepast en daarna geëvalueerd. |
Rankin scale, modified Hughes functional grading scale en de 9-item Rotterdam handicap scale. |
|
subgroup met f-score = 1: hogere mediane waarde op Rotterdam schaal dan de andere subgroepen. Subgroep met zelfstandig lopende patiënten: sign. hogere mediane score dan niet-zelfstandige groep. In stabiele groep patiënten (n=133): sign. correlatie tussen de Rotterdam en de Rankin schaal. Responsiviteit aangetoond in de groep patiënten (n=20) die recent gediagnosticeerd waren. |
|
|
Merkies, 2000 |
|
deels cross-sectioneel, deels prospectief 8 artsen (w.o. 2 neurologen) namen in wisselende koppels de testen af (elke patiënt werd 2x onderzocht). De pas gediagnosticeerde patiënten werden 11x onderzocht in een jaar. |
N=133 (allen uit Rotterdamse immuungemedieerde polyneuropathie databank of de NL GBS-studie); 113 stabiele patiënten (83 GBS, 22 CIDP, 8 MGUSP) met een mediane duur van symptomen van 5,1 jaar en 20 patiënten met recent gediagnosticeerde GBS (n=7) of CIDP (n=13). Daarnaast controlegroep (n=530) met gezonde personen, lft. 5-93 jaar. |
Voor patiëntengroep: internationale ziektecriteria. Voor gezonde proefpersonen: normaal cognitief functioneren, ADL-zelfstandig, sociaal actief, geen handicap bovenste ledematen, normale lichamelijke ontwikkeling bij kinderen. |
Doel: evalueren van de Vigorimeter als instrument voor het meten van de handknijpkracht. |
Handknijpkracht m.b.v. de Vigorimeter en de ADS-schaal (functionele beschrijving armen) |
handknijpkracht |
Gezonde proefpersonen: gering verschil tussen dominante en niet-dominante hand. Max. mediane knijpkracht rond 30e jaar. Mediane knijpkracht sign. associatie met leeftijd en bij mannen ook met handomtrek. Redelijk tot goede correlatie tussen Vigorimeter en ADS-waarden. Hoge inter- en intra-observer waarden. Goede responsiviteit. |
|
|
Merkies, 2006 |
|
prospectief cohort-onderzoek |
20 patiënten (12 m/ 8 v; mediane lft. 54 jaar (15-70)) met recent gediagnosticeerde GBS (n=7) of CIDP (n=13). 13 (6 met GBS) niet in staat tot zelfstandig lopen of gebonden aan bed. 19 kregen IVIg.
|
internationale ziektecriteria.
|
Doel: nagaan of er een associatie is tussen de uitkomsten van meetinstrumenten (m.n. de ODSS) voor lichamelijke beperkingen en het eigen oordeel van de patiënt . |
Bij 11 meetmomenten: ODSS 9-hole Peg test modified Rankin scale GBS disability scale
Bij 7 meetmomenten: SF-36 |
|
ODSS gaf voor 8 van de 10 SF-36 dimensies de hoogste associatie t.o.v. de andere nstrumenten. Wanneer patiënten zelf de klinische conditie gradeerden werden sign. associaties gevonden met veranderingen op de ODSS (p=0,007), Rankin (p=0,02) en de GBS disability scale (p=0,04) |
|
|
Merkies, 2000 |
|
deels cross-sectioneel, deels prospectief. 8 artsen (w.o. 2 neurologen) namen in wisselende koppels de testen af (elke patiënt werd 2x onderzocht). De pas gediagnosticeerde patiënten werden 11x onderzocht in een jaar. |
113 stabiele patiënten (83 GBS, 22 CIDP, 8 MGUSP) met een mediane duur van symptomen van 5,1 jaar. Daarnaast 20 patiënten met recent gediagnosticeerde GBS (n=7) of CIDP (n=13). Allen uit de Rotterdamse immuungemedieerde polyneuropathie databank of de NL GBS-studie. Stabiele patiënten: 59 m/54 v; mediane lft. 56 jaar (14-84). “Recente” patiënten: 12 m/8 v; mediane lft. 54 jaar (15-70). |
|
Doel: testen van betrouwbaarheid en responsiviteit van de Rydel-Seiffer stemvork. |
Score gebaseerd op het gemiddelde van 3 metingen per meetplek (metend van distaal naar proximaal aan armen en benen). 0=geen afwijkingen; max. 8= afwijking aan het acromioclaviculair gewricht of spina iliaca ant. sup. |
|
Stabiele groep: mediane totale (armen en benen) score: 1. Goede intra- en interobserver waarden. Longitudinale groep: mediane score op t=0: 4. Verbetering leidde tot algemene reductie in totale vibratiegraden. |
|
|
Merkies, 2002 |
|
deels cross-sectioneel, deels prospectief. De cross-sectionele groep onderging alle testen eenmalig, de longitudinale groep onderging de testen 11 keer. |
N=134 (allen uit Rotterdamse immuungemedieerde polyneuropathie databank of de NL GBS-studie); 114 stabiele patiënten (83 GBS, 22 CIDP, 8 MGUSP) met een mediane duur van symptomen van 6,8 jaar en 20 patiënten met recent gediagnosticeerde GBS (n=7) of CIDP (n=13). In de stabiele groep 14 patiënten met loophulpmiddel en 8 bedlegerig. |
internationale ziektecriteria en geen comorbiditeit die invloed kan hebben op kwaliteit van leven.
|
Doel: evalueren van de SF-36 als meetinstrument bij patiënten met immuun-gemedieerde polyneuropathie. Andere meetinstrumenten: MRC sumscore, Hughes functional grading scale, INCAT sensory sumscore. |
|
|
gem. waarden op SF-36 subschalen en gem. sumscores voor de groep stabiele patiënten sign. lager dan gem. normaalwaarden. Longitudinale patiënten: geleidelijke toename van QoL; (muv. fysieke domeinen en fysieke sumscore) bereikten alle domeinen normale waarden binnen een jaar na optreden ziekte. Geen sign. correlatie tussen sumscores en leeftijd of duur van symptomen. Goede interne consistentie voor alle domeinen. Grootste associatie tussen lichamelijk georiënteerde SF-36 onderdelen en de MRC sumscore en de waarden van de F-score. Een redelijk (voor de domeinen pijn en alg. perceptie van de gezondheid) tot hoge responsiviteit. |
|
|
Graham, 2006 |
|
Cross-sectioneel |
n=65; 36 m/29v, gem. lft. 57 jaar (20-84). 50 opeenvolgende patiënten die werden opgenomen met een perifere neuropathie en 15 vrijwilligers met perifere neuropathie. Diagnosen: o.a. GBS (n=18), CIDP (n=26). |
niet vermeld |
Doel: testen bruikbaarheid “12-item walking scale (MSWS-12)” bij patiënten met perifere neuropathie. Andere testen: MRC sumscore, 10- meter looptest, “overall disability sum score (ODSS)” en “overall neuropathy limitations scale (ONLS)”. Bij 15 patiënten tevens SF-36 en bij 12 deelnemers na 1week herhaling MSWS-12. |
|
|
Interne consistentie MSWS-12 uitstekend (Cronbach’s α: 0,97). Geen sign. verschillen bij herhaalde metingen. Intraclass correlatie coefficient hoog (0,96). Sterke correlatie met lichamelijke functie subschaal van de SF-36. Scores sign. hoger voor deelnemers met een loophulpmiddel t.o.v. personen zonder. |
|
|
Merkies, 2000 |
|
deels cross-sectioneel, deels prospectief. 8 artsen (w.o. 2 neurologen) namen in wisselende koppels de testen af (elke patiënt werd 2x onderzocht). De pas gediagnosticeerde patiënten werden 11x onderzocht in een jaar. |
N=134 (allen uit Rotterdamse immuungemedieerde polyneuropathie databank of de NL GBS-studie); 114 stabiele patiënten (83 GBS, 22 CIDP, 8 MGUSP) met een mediane duur van symptomen van 5,1 jaar en 10 patiënten met recent gediagnosticeerde GBS (n=4) of CIDP (n=6). Stabiele groep: 59 m/54 v, mediane lft. 56 jaar (14-84) |
|
Doel: ontwikkelen en testen van een nieuwe sensorische schaal: “Incat sensory sumscore (ISS)”. Eerst systematische literatuursearch naar alle sensorische methoden en consensusvorming door een panel van experts. |
ISS bestaat uit pinprick en vibratiezin aan armen en benen en twee-punt discriminatietest aan distale phalanx wijsvinger. Score voor pinprick en vibratiezin: 0=geen afwijkingen; max. 4= afwijking aan het acromio-claviculair gewricht of spina iliaca ant. sup.. Voor de twee-punt discriminatietest: 0≤4 mm t/m 4≥20 mm. |
Overige testen voor correlatie en regressie studies: nine-hole peg test, 10-meter looptest en een overall disability sumscore |
Goede interne consistentie. Redelijke correlatie met de andere schalen in de stabiele groep als teken van de validiteit. Inter- en intraobserver betrouwbaarheid: R=0,85 en R=0,89 (p<0,0001). Algemene afname in ISS waarden gedurende follow-up; sign. geassocieerd met klinische beoordelingsscores bij deze patiënten. |
|
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 24-01-2011
Laatst geautoriseerd : 24-01-2011
Geplande herbeoordeling : 01-01-2021
Uiterlijk in 2020 wordt door de Vereniging Spierziekten Nederland (VSN), na raadpleging van of op advies van aan de richtlijn participerende verenigingen, bepaald of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om (delen van) de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Algemene gegevens
Ook geautoriseerd door
- Uitvoeringsinstituut WerknemersVerzekeringen
In samenwerking met
- Agis Zorgverzekeringen
- Koninklijk Nederlands Genootschap voor Fysiotherapie
- Nederlands Huisartsen Genootschap
- Nederlandse Vereniging voor Cardiologie
- Nederlandse Vereniging voor Psychologen
- Vereniging Samenwerkingsverband Chronische Ademhalingsondersteuning
De richtlijn is tot stand gekomen met ondersteuning van Kwaliteitsinstituut voor de Gezondheidszorg (CBO) en met financiële steun ZonMw in het kader van het programma Kennisbeleid, Kwaliteit Curatieve Zorg.
Het Guillain-Barré syndroom (GBS) is een zeldzame ziekte met een zeer zware ziektelast. De ziekte leidt binnen enkele uren tot dagen tot verlammingsverschijnselen. Ongeveer 25% van de patiënten met het Guillain-Barré syndroom heeft kunstmatige beademing nodig waarvoor de patiënt wordt opgenomen op de IC.
Sommige patiënten herstellen volledig, maar een groot deel niet. Oud-patiënten geven aan dat met name de niet-zichtbare handicaps van de ziekte zoals een snelle vermoeidheid, beperkte belastbaarheid en pijn niet onderkend worden door bedrijfs- en verzekeringsartsen. Hierdoor worden regelmatig verkeerde re-integratietrajecten ingezet met alle gevolgen van dien.
Het zeldzaam vóórkomen van het Guillain-Barré syndroom maakt dat de parate kennis van veel behandelaars over deze ziekte beperkt is. Dit heeft tot gevolg dat er regelmatig gekozen wordt voor een eigen beleid dat afwijkt van de ‘best practice’. Dit gebeurt zowel tijdens de progressieve en plateaufase als tijdens de herstel- en late fase. Het is daarom belangrijk na te gaan welke behandeling de beste is en hoe het re-integratietraject optimaal vorm gegeven kan worden.
Bovengenoemde overwegingen waren voor de patiëntenvereniging, de Vereniging Spierziekten Nederland (VSN), aanleiding het initiatief te nemen voor de ontwikkeling van een multidisciplinaire, ‘evidence-based’ richtlijn voor diagnostiek en behandeling van het Guillain-Barré syndroom. Het Kwaliteitsinstituut voor de Gezondheidszorg CBO verleende hierbij methodologische expertise.
Doel en doelgroep
Doelstelling
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. Er wordt aangegeven wat in het algemeen de beste zorg is voor patiënten met het Guillain-Barré syndroom. De richtlijn geeft aanbevelingen over de diagnostiek, verwijzing, behandeling en re-integratie van patiënten met het Guillain-Barré syndroom en kan worden gebruikt bij het geven van voorlichting aan patiënten. Ook biedt de richtlijn aanknopingspunten voor bijvoorbeeld transmurale afspraken of lokale protocollen ter bevordering van de implementatie.
Het doel is het verkrijgen van uniformiteit in de diagnostiek, behandeling en begeleiding in de diverse centra en het definiëren van de kaders waarbinnen de multidisciplinaire zorg van patiënten met het Guillain-Barré syndroom moet plaatsvinden. Deze richtlijn zal naar verwachting ook bijdragen aan verbeterde communicatie tussen behandelaars en patiënten en tussen behandelaars onderling.
Specifieke doelen van deze richtlijn zijn:
- het voorkómen van gezondheidsschade bij patiënten door het geven van concrete aanbevelingen over verbeterde diagnostische en therapeutische mogelijkheden;
- het doen van duidelijke uitspraken over te verrichten diagnostiek en behandeling van GBS bij volwassenen en kinderen en over het te volgen re-integratietraject.
Doelgroep
De richtlijn is bedoeld voor alle zorgverleners die bij de behandeling en begeleiding van patiënten met het Guillain-Barré syndroom betrokken zijn, met name huisartsen, (kinder)neurologen, revalidatieartsen, kinderartsen, bedrijfs-/verzekeringsartsen, fysiotherapeuten, psychologen en (IC-)-verpleegkundigen.
Samenstelling werkgroep
Voor het ontwikkelen van deze richtlijn is in 2008 een multidisciplinaire werkgroep samengesteld bestaande uit vertegenwoordigers van alle bij de diagnostiek, behandeling en begeleiding van patiënten met het Guillain-Barré syndroom betrokken medische disciplines, beleidsmedewerkers van de patiëntenvereniging, de Vereniging Spierziekten Nederland (VSN) en adviseurs van het Kwaliteitsinstituut voor de Gezondheidszorg CBO (zie hieronder).
Bij het samenstellen van de werkgroep is rekening gehouden met de geografische spreiding van de werkgroepleden, met een evenredige vertegenwoordiging van de verschillende betrokken verenigingen en instanties alsmede met een spreiding al dan niet in academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en waren gemandateerd door hun vereniging. Een overzicht van de belangenverklaringen van werkgroepleden over mogelijke financiële belangenverstrengeling is als addendum bij de richtlijn gevoegd.
Samenstelling werkgroep
- Dhr. prof.dr. P.A. van Doorn, neuroloog, Eramus Medisch Centrum, Rotterdam, voorzitter
- Dhr. dr. J.W.G. Meijer, revalidatiearts, Revant Revalidatiecentrum Breda, vicevoorzitter
- Dhr. drs. E.S. Alberga, bedrijfsarts, Groningen
- Mw. dr. N. van Alfen, neuroloog, Universitair Medisch Centrum St. Radboud, Nijmegen
- Dhr. mr.drs. E.R. Berends, verzekeringsgeneeskundige, UWV, Assen
- Mw. drs. H.A. Berendsen, revalidatiearts, Sophia Revalidatie, Delft
- Dhr. dr. R.A.J.A.M. Bernsen, neuroloog, Jeroen Bosch Ziekenhuis, ’s Hertogenbosch
- Mw. mr. P.H. Blomkwist-Markens, voorzitter diagnosewerkgroep GBS/CIDP, Vereniging Spierziekten Nederland, Amsterdam
- Mw. dr. J.G. Broeks, revalidatiearts, Scheperziekenhuis, Emmen
- Dhr. dr. P.G. Erdmann, fysiotherapeut / bewegingswetenschapper, Universitair Medisch Centrum, Utrecht
- Mw. T. Dingelhoff, secretaresse Vereniging Spierziekten Nederland, Baarn
- Mw. drs. J.M. van Haelst, revalidatiearts, Revalidatiecentrum Tolbrug, Oss
- Mw. dr. A.M.C. Horemans, hoofd kwaliteit van zorg, Vereniging Spierziekten Nederland, Baarn, projectleider
- Dhr. dr. M. van der Jagt, neuroloog-intensivist, Erasmus Medisch Centrum, Rotterdam
- Mw. dr. L. Kok, arts-epidemioloog, Kwaliteitsinstituut voor de Gezondheidszorg CBO, Utrecht
- Dhr. W.J. Lubbers, huisarts, Gezondheidscentrum Parkwijk, Almere
- Mw. J.H.A.T. van Mierlo, lid diagnosewerkgroep GBS/CIDP, Vereniging Spierziekten Nederland, ’s Hertogenbosch
- Dhr. dr. W.L. van der Pol, neuroloog, Universitair Medisch Centrum, Utrecht
- Mw. drs. M. Rol, revalidatiearts, Den Haag
- Mw. dr. K. Rosenbrand, arts, Kwaliteitsinstituut voor de Gezondheidszorg CBO, Utrecht
- Mw. dr. E.H. Tromp, klinisch neuropsycholoog, Revalidatiecentrum Tolbrug, Oss
- Mw. M. Twigt, IC-verpleegkundige, Hoofddorp
- Mw. drs. F. de Wit, beleidsmedewerker kwaliteit van zorg, Vereniging Spierziekten Nederland, Baarn
- Mw. drs. M. van der Wurff, medewerker communicatie, Vereniging Spierziekten Nederland, Baarn
Adviseurs GBS-richtlijn
- Dhr. dr. B. van den Berg, internist-intensivist, Erasmus Medisch Centrum, Rotterdam
- Mw. drs. J. Blees, kinderrevalidatiearts, Revalidatiecentrum De Trappenberg, Huizen
- Mw. dr. N.A.M. Cobben, longarts-intensivist, Academisch Ziekenhuis – Centrum voor Thuisbeademing, Maastricht
- Dhr. A. Comuth, kinderfysiotherapeut, Adelante kinderrevalidatie, speciaal onderwijs & wonen, Valkenburg
- Dhr. J. Crasborn, directeur strategie, AGIS, Amersfoort
- Dhr. dr. M.P.J. Garssen, neuroloog, Jeroen Bosch Ziekenhuis, ’s Hertogenbosch
- Dhr. dr. B.C. Jacobs, neuroloog, Erasmus Universiteit, Rotterdam
- Dhr. dr. J.L.M. Jongen, neuroloog, Erasmus Medisch Centrum, Rotterdam
- Dhr. dr. E.J.O. Kompanje, senior onderzoeker/klinische ethicus Intensive Care, Erasmus Medisch Centrum, Rotterdam
- Mw. dr. R. van Koningsveld, neuroloog, Elkerliek Ziekenhuis, Helmond
- Mw. G. Lammers, maatschappelijk werker, Revalidatiecentrum ’t Roessingh, Enschede
- Dhr. dr. I.S.J. Merkies, neuroloog, Spaarne Ziekenhuis, Hoofddorp
- Dhr. K.D. Pelger, fysiotherapeut, Mytylschool Gabriel, ’s Hertogenbosch
- Mw. dr. L. Ruts, neuroloog, Havenziekenhuis Rotterdam
- Mw. dr. L.T.L. Sie, kinderneuroloog, Universitair Medisch Centrum St. Radboud, Nijmegen
- Dhr. B. Verdonk, fysiotherapeut, Universitair Medisch Centrum, Utrecht
- Mw. M. Versluis, senior-beleidsmedewerker, NPCF, Utrecht
- Mw. drs. C. Walgaard, neuroloog i.o., Erasmus Medisch Centrum, Rotterdam
- Mw. E. Wiarda Rosen Jacobson, logopedist, Erasmus Medisch Centrum, Rotterdam
- Mw. J.C. Wijnen, diëtist, lid werkgroep diëtisten en spierziekten DVN, Oss
Inbreng patiëntenperspectief
Bij het opstellen van de richtlijn is rekening gehouden met het patiëntenperspectief. In de knelpuntanalyse heeft de betrokken patiëntenvereniging (VSN) eigen knelpunten tijdens een focusgroepbijeenkomst ingebracht. De conceptrichtlijn is ook voorgelegd aan de betrokken patiëntenvereniging (VSN). Tot slot zijn of worden de gegevens uit deze richtlijn verwerkt in het voorlichtingsmateriaal van deze patiëntenvereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De richtlijn wordt verspreid onder alle relevante beroepsgroepen en ziekenhuizen. Ook wordt een samenvatting van de richtlijn ter publicatie aangeboden aan het Nederlands Tijdschrift voor Geneeskunde en zal er in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Daarnaast wordt de integrale tekst van de richtlijn op de websites van de patiëntenvereniging (VSN), het CBO en de betrokken beroepsverenigingen geplaatst.
Om de implementatie en evaluatie van deze richtlijn te stimuleren, zal de werkgroep een implementatieplan opstellen en een lijst van indicatoren ontwikkelen aan de hand waarvan de implementatie kan worden gemeten. Indicatoren geven in het algemeen de zorgverleners de mogelijkheid te evalueren of zij de gewenste zorg leveren. Zij kunnen daarmee ook onderwerpen voor verbeteringen van de zorgverlening identificeren.
De richtlijn wordt getoetst bij de eindgebruiker in de verschillende regio’s en wetenschappelijke verenigingen, waarbij ook visitaties zullen worden georganiseerd.
Werkwijze
Gezien de omvang van het werk werd een aantal subgroepen gevormd met vertegenwoordigers van relevante disciplines. De voorzitter en subvoorzitter zorgden samen met beleidsmedewerkers van de VSN en de adviseurs van het CBO voor de coördinatie en onderlinge afstemming van de subgroepen.
De werkgroep heeft gedurende een periode van ongeveer twee jaar gewerkt aan de tekst voor de conceptrichtlijn. De subgroepen beoordeelden de door de adviseurs van het CBO geschreven wetenschappelijke onderbouwingen en formuleerden vervolgens de overige overwegingen en aanbevelingen. Tevens schreven de subgroepen consensusteksten wanneer wetenschappelijk bewijs voor het beantwoorden van de uitgangsvraag ontbrak. De teksten werden tijdens plenaire vergaderingen besproken en na verwerking van de commentaren geaccordeerd. De voltallige werkgroep is twintigmaal (tien keer lijfelijk en tien keer telefonisch) bijeengeweest om de resultaten van de subgroepen in onderling verband te bespreken. De teksten van de subgroepen zijn door een redactieteam samengevoegd en op elkaar afgestemd tot één document: de conceptrichtlijn. Deze werd in juni 2010 aan de bij de richtlijn betrokken verenigingen verstuurd voor commentaar. Na verwerking van het commentaar is de richtlijn in november 2010 door de voltallige werkgroep vastgesteld en ter autorisatie naar de relevante beroepsverenigingen gestuurd.
De kwaliteit van deze artikelen werd door epidemiologen van het CBO beoordeeld aan de hand van ‘evidence-based richtlijnontwikkeling’ (EBRO)-beoordelingsformulieren. Artikelen van matige of slechte kwaliteit werden uitgesloten. Na deze selectie bleven de artikelen over die als onderbouwing bij de verschillende conclusies in de richtlijn staan vermeld. De geselecteerde artikelen zijn vervolgens gegradeerd naar de mate van bewijs waarbij de volgende indeling is gebruikt (tabel 1). De mate van bewijskracht en niveau van bewijs zijn in de conclusies van de verschillende hoofdstukken weergegeven. De belangrijkste literatuur waarop de conclusies zijn gebaseerd, is daarbij vermeld.
Indeling van de literatuur naar mate van bewijskracht
Tabel 1. Indeling van methodologische kwaliteit van individuele studies
|
|
Interventie |
Diagnostisch accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
A1 |
Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang. |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad. |
Prospectief cohortonderzoek van voldoende omvang en follow-up waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontrole- onderzoek, cohort-onderzoek). |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontroleonderzoek, cohortonderzoek). |
Vergelijkend onderzoek maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiëntcontroleonderzoek, cohortonderzoek). |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk, dan geldt de classificatie voor interventies.
Tabel 2. Niveau van conclusies
|
|
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2, met consistent resultaat |
|
2 |
Eén onderzoek van niveau A2 of ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
Eén onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Totstandkoming van de aanbevelingen
Voor het komen tot een aanbeveling zijn er naast het wetenschappelijk bewijs vaak andere aspecten van belang zoals patiëntenvoorkeuren, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke consequenties of kosten. Deze aspecten worden besproken na de ‘Conclusie’ in de ‘Overige overwegingen’. Hierin wordt de conclusie op basis van de literatuur in de context van de dagelijkse praktijk geplaatst en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van het beschikbare bewijs in combinatie met deze overwegingen. Het volgen van deze procedure en het opstellen van de richtlijn in dit ‘format’ heeft als doel de transparantie van de richtlijn te verhogen. Het biedt ruimte voor een efficiënte discussie tijdens de werkgroepvergaderingen en vergroot bovendien de helderheid voor de gebruiker van de richtlijn.
De richtlijn is niet allesomvattend
Bij het opstellen van de richtlijn is uitgegaan van de op dit moment belangrijkste knelpunten en aandachtspunten in de behandeling en begeleiding van patiënten met GBS. Deze punten zijn door oud-patiënten en zorgverleners aangedragen en vertaald in uitgangsvragen voor de richtlijn. De richtlijn beoogt geen allesomvattend leerboek te zijn maar biedt praktische aanknopingspunten voor zorgverleners bij de belangrijkste uitgangsvragen.
Bij het beantwoorden van de uitgangsvragen is uitgegaan van de zorg die specifiek is voor patiënten met GBS. De gebruikelijke zorg en de algemeen gangbare activiteiten zijn niet vermeld in de richtlijn. Dit houdt in dat bijvoorbeeld algemeen therapeutische zorg alleen dan vermeld wordt als deze afwijkt van de algemeen gangbare therapeutische interventies (zoals verwacht volgens de algemeen geldende stand van wetenschap en praktijk).
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
