Antibiotica bij COPD
Uitgangsvraag
Wanneer is het voorschrijven van antibiotica geïndiceerd bij patiënten die worden opgenomen in het ziekenhuis met een acute COPD-longaanval?
Aanbeveling
Geef patiënten die opgenomen worden in verband met een COPD-longaanval antibiotica alleen als er klinisch (koorts en sputumconversie) en/of radiologisch tekenen zijn van bacteriële infectie.
Overweeg antibiotica indien er sprake is van een verlaagd bewustzijn, desoriëntatie, ademhalingsfrequentie >30 per minuut, hoge leeftijd, relevante comorbiditeit, ernstig verlaagd FEV1.
Start in principe met doxycycline (vijf tot tien dagen) en indien hiervoor contra-indicaties zijn met amoxicilline /clavulaanzuurdoxycycline, tenzij er gegronde redenen zijn voor een andere keuze.
Overwegingen
Alhoewel in richtlijnen en leerboeken gesproken wordt over een gunstig effect van het toedienen van antibiotica bij een COPD-longaanval kon hier in de literatuur weinig bewijs voor gevonden worden. Wel zijn er diverse studies, die niet voldoen aan de zoekcriteria, die een voordeel laten zien dat vooral bij patiënten met een ernstig COPD (lage FEV1) de opnameduur korter is en de mortaliteit lager. Over het algemeen zijn deze studies oud, includeerden kleine patiënten aantallen, werden niet gecontroleerd met een placebo en in het buitenland uitgevoerd. Ook werden in die studies van oudere datum geen corticosteroïden standaard toegevoegd, zoals in de studie van Daniels wel het geval was (2010).
In de GOLD richtlijn van 2016 wordt geadviseerd patiënten met een longaanval, purulent sputum en/of toename van sputum antibiotica te geven evenals patiënten met een beademingsindicatie (GOLD, 2016).
De kracht van de studie van Daniels (2010) is de studieopzet: gerandomiseerd en dubbelblind. Hier werd in een subgroepanalyse bij patiënten met ernstig COPD geen voordeel gevonden boven patiënten met matig ernstig COPD. Daarnaast bleek uit de studie dat patiënten met een hoger CRP (>50 mg/L) meer voordeel hebben bij behandeling met antibiotica dan patiënten met een laag CRP (<50 mg/L). In een subgroep analyse op dag 10 is er bij patiënten met een CRP ≥50 mg/L een groter effect van de behandeling met doxycycline dan in de placebogroep. Dit effect is niet waarneembaar bij de groep met een CRP <50 mg/L. De studieopzet was niet gericht op het nagaan van de bruikbaarheid van CRP-geleide therapie bij een COPD-longaanval. Om te beoordelen of CRP een bruikbare maat is om het antibiotica beleid te bepalen bij een COPD-longaanval is eerst verder onderzoek nodig. In een deel van de studies is onbekend welke patiënten al antibiotica gehad hadden in de thuissituatie voordat ze opgenomen werden. Bij de studie van Daniels had niemand ≥24 uur antibiotica in de thuissituatie gehad. Men kan zich voorstellen, dat het wel of niet behandeld zijn met antibiotica in de thuissituatie de studie uitkomsten kan beïnvloeden bij op te nemen patiënten met een longaanval van COPD. De gerapporteerde bijwerkingen van de gebruikte antibiotica, zijn milde maagdarmbezwaren die allen self-limiting waren. Er is geen verklaring te geven voor de verhoogde mortaliteit in de Doxycycline-groep. Zeer waarschijnlijk is dit overlijden niet ten gevolge van de gebruikte studiemedicatie maar ten gevolge van de onderliggende ziekte.
Overigens werd in de studie van Alonso Martinez, 1992 niet aangetoond dat de tijd tot een volgende longaanval langer duurde bij placebo dan bij doxycycline behandeling. In ieder geval niet binnen 30 dagen van de follow-up.
Naar aanleiding van het feit dat uit de studie van Daniels blijkt dat de symptomen sneller verdwenen na antibiotische behandeling, kan men afleiden dat de opnameduur ook korter kan zijn indien de patiënt met antibiotica behandeld wordt. Dit zou een groot voordeel zijn voor de patiënt en ook tot afname van de zorgkosten leiden. Het tijdig en doelmatig gebruik van antibiotica draagt bij tot een kwalitatieve verbetering van de zorg en waarschijnlijk tot kostenreductie.
Het aantonen van bacteriën in een sputumkweek op zich is geen reden om antibiotica te starten. Het is bekend dat ook bij patiënten met stabiele COPD in de sputumkweek bacteriën geïsoleerd kunnen worden. Waarschijnlijk betreft dit kolonisatie. De resistentiepercentages voor S. pneumoniae zijn de afgelopen jaren niet wezenlijk veranderd: penicilline <1%, macroliden 10%, doxycycline 9%. Voor H. Influenzae is de resistentie voor amoxicilline toegenomen van 14% naar 20% en de resistentie voor amoxicilline/clavulaanzuur naar 6%, voor doxycycline ligt dit tussen de 1 en 3%. Voor beide verwekkers geldt dat er geen grote verschillen in resistentie zijn tussen de eerste en tweede lijn en dat er zeer waarschijnlijk geen grote regionale verschillen zijn (eerste lijnsgegevens zijn niet geheel betrouwbaar) (NethMap 2016).
Overigens zijn er aanwijzingen dat de pathogenen die betrokken zijn bij een acute longaanval anders dan bij een community acquired pneumonie (CAP). In de studie van Daniels (2010) waren de meest geïsoleerde bacteriën bij een acute longaanval in het ziekenhuis: H. Influenza, daarna S. pneumoniae en op de derde plaats M. Catarrhalis. In de studie van Van der Eerden (2005) waren de meest geïsoleerde verwekkers bij CAP: S. Pneumoniae, daarna Mycoplasma en in de derde plaats pas H. Influenzae.
Gezien het resistentie patroon van H.Influenzae in de Nederlandse setting (Nethmap, 2016) is het advies om, als er met antibiotica gestart moet worden bij een acute longaanval met een ziekenhuis opname, als eerste voor doxycycline als antibioticum te kiezen en als tweede keus amoxicilline-clavulaanzuur te geven. Verder wetenschappelijk onderzoek om dit te onderbouwen is noodzakelijk. Hierbij zou moeten worden onderzocht of er verschil bestaat tussen de klinische behandeling van een COPD-patiënt met een CAP, ten opzichte van een acute longaanval door een bacteriële luchtweginfectie. De data uit de CAP-studie kunnen hier goed voor gebruikt worden in een sub-analyse bij patiënten met COPD.
Indien uit voorgaande sputumkweken is gebleken dat er pseudomonas species geïsoleerd zijn, verdient het aanbeveling te starten met een antibioticum dat ook deze pathogenen dekt. Vaak is dit het geval bij patiënten met structurele afwijkingen aan de luchtwegen, zoals bronchopathie of bronchiëctasieën.
Bij een COPD-longaanval kan overwogen worden om met antibiotica te starten als er klinische aanwijzingen zijn voor een bacteriële luchtweginfectie, zoals koorts en veranderde hoeveelheid en/of kleur van het sputum, of als er sprake is van infiltratieve veranderingen op de X-Thorax. Ook als de klinische symptomen wijzen op sepsis moet met antibiotica gestart worden. Denk hierbij aan (dreigende) respiratoire insufficiëntie, systolische bloeddruk <90mmHg, desoriëntatie, verminderd bewustzijn. Ook een verhoogd risico zoals bij hoge leeftijd en de aanwezigheid van relevante comorbiditeit, kunnen een indicatie vormen om sneller te starten met antibiotica.
Onderbouwing
Achtergrond
De trigger van een COPD-longaanval zou in ongeveer 50 tot 70% van de situaties een luchtweginfectie zijn. Goede literatuur om dit te onderbouwen ontbreekt op dit moment echter. De behandeling met antibiotica is niet vanzelfsprekend om verschillende redenen. In de helft van de situaties betreft het een virale verwekker en bij de andere helft een bacteriële verwekker. De aanwezigheid van een bacterie in de sputumkweek wil nog niet zeggen dat er ook een infectie is met deze verwekker. Ook tijdens de stabiele fase van de ziekte kunnen bacteriën gekweekt worden bij patiënten met COPD. Er bestaat nog veel onduidelijkheid over de toepassing en het nut van antibiotica bij een ernstige COPD-longaanval. In de literatuur wordt regelmatig gesteld dat antibiotica bij een subpopulatie met een longaanval de tijd tot een volgende longaanval zal verlengen. Of dit bewezen kan worden is onduidelijk alsmede bij welke subpopulatie patiënten dit dan geldt.
Veel literatuur is afkomstig uit landen met een ander patroon van verwekkers en andere resistentiespectra. Dit maakt toepassen van het bewijs voor onze populatie niet eenvoudig.
Conclusies
|
Laag GRADE |
Het risico op het falen van behandeling is mogelijk lager bij een behandeling met antibiotica vergeleken met placebo in COPD-patiënten opgenomen voor een acute longaanval.
Bronnen (Daniels, 2010; Alonso Martinez, 1992) |
|
Laag GRADE |
Het risico om te overlijden is mogelijk hoger bij een behandeling met doxycycline vergeleken met placebo in COPD-patiënten opgenomen voor een acute longaanval.
Bronnen (Daniels, 2010) |
|
Laag GRADE |
Opnameduur bij gebruik van antibiotica is mogelijk niet verschillend vergeleken met placebo in COPD-patiënten opgenomen voor een acute longaanval.
Bronnen (Alonso Martinez, 1992) |
|
Matig GRADE |
Gebruik van antibiotica door COPD-patiënten opgenomen voor acute longaanval leidt mogelijk niet tot een verbetering in longfunctie vergeleken met placebo.
Bronnen (Daniels, 2010) |
Samenvatting literatuur
Beschrijving studies
Daniels (2010) ondernam een gerandomiseerde placebo gecontroleerde trial naar de effecten van doxycycline, naast systemische corticosteroïden, op klinische en microbiologische uitkomsten, longfunctie, en systemische ontsteking bij patiënten opgenomen voor een COPD-longaanval. Patiënten ouder dan 45 jaar, gediagnosticeerd met COPD volgens de GOLD standaard en met een longaanval die opname vereiste, waren geïncludeerd. Patiënten ontvingen een zeven daagse behandeling met doxycycline (200 mg dd.) of met placebo. Alle patiënten kregen systemische corticosteroïden, een vernevelde bronchusverwijder vier tot zes maal per dag en fysiotherapie naast de onderzochte behandeling. Prednisolon werd gegeven in het volgende schema: intraveneus 60 mg per dag met een afname in dosering van 10 mg per twee dagen tot 40 mg per dag gevolgd door 30 mg van orale prednisolon op dag 7 met een afname in dosering van 5 mg per twee dagen tot 0 mg of tot de dosering van onderhoudsbehandeling gestart voor de trial. In totaal werden 265 longaanvallen in 223 patiënten geïncludeerd. 107 patiënten met 128 longaanvallen waren naar doxycycline gerandomiseerd en 116 patiënten met 137 longaanvallen naar placebo. Hierbij werden sputumkweek en C-reactief proteïne meegenomen maar vormden geen in- of exclusiecriterium.
Alonso Martinez (1992) onderzocht het effect van antibiotica bij patiënten opgenomen voor een longaanval met klinische verdenking op COPD. In totaal waren 90 patiënten door middel van een loting gerandomiseerd. 29 patiënten ontvingen trimethoprim- sulfamethoxazol oraal 2x 960 mg. per dag, 32 amoxicilline/clavulaanzuur oraal 3x 625 mg per dag en 29 patiënten kregen placebo. Duur van behandeling was voor allen acht dagen. Alle patiënten ontvingen naast de interventie of placebo theophylline, geïnhaleerde bronchusverwijders en zuurstof.
Resultaten
1. Falen van behandeling
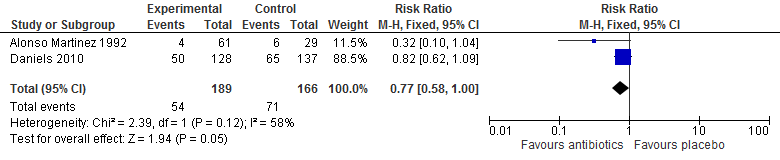
Daniels (2010) definieerde falen van behandeling in de trial als het ontbreken van een volledige verbetering van de symptomen, verergering van symptomen of het optreden van nieuwe symptomen geassocieerd met de primaire indicatie, nieuwe infectie of overlijden. De primaire uitkomstmaat was ‘cure of improvement’ binnen 30 dagen. Volgens deze definitie faalde in totaal de behandeling bij 50 patiënten onder behandeling van doxycycline vergeleken met 65 patiënten bij placebo. Het risico op het falen van de behandeling was 18% lager bij doxycycline vergeleken met placebo (RR 0,82 95%BI: 0,62 tot 1,09).
Alonso Martinez (1992) hanteerde de volgende definitie van het falen van behandeling: gebruik van additionele antibiotica. In totaal gebruikte vier (7%) patiënten additionele antibiotica in de trimethoprim-sulphamethoxazole en amoxicilline/clavulaanzuur armen vergeleken met zes (21%) patiënten in de placebo arm. De kans dat patiënten additionele antibiotica gebruikten in de gepoolde actieve armen was 70% lager vergeleken met de controle arm (RR 0,32 95%BI: 0,10 tot 1,04).
De resultaten van deze twee trials werden gepoold Het risico op het falen van behandeling met antibiotica was 23% lager vergeleken met placebo (RR 0,77 95%BI: 0,58 tot 1,00).
Tabel 1
2. Terugval
Data over terugval zijn in beide trials niet gerapporteerd.
3. Mortaliteit
In de trial van Daniels (2010) waren zeven (5%) patiënten overleden in de groep die doxycycline kregen vergeleken met drie (2%) patiënten in de placebogroep. Het risico om te overlijden is 153% hoger bij gebruik van doxycycline vergeleken met placebo (RR 2,53 95%BI: 0,67 tot 9,53).
Alonso Martinez, 1992 rapporteerde geen data over mortaliteit.
4. Opnameduur
Daniels (2010) heeft geen data over opnameduur gerapporteerd.
Alonso Martinez, 1992 observeerde dat patiënten onder behandeling met antibiotica gemiddeld 7,9 (SD 2,1) dagen waren opgenomen vergeleken met gemiddeld 8,1 (SD 2,4) dagen bij gebruik van een placebo. Het gemiddeld verschil tussen interventie en placebo bedroeg een afname van 0,2 dagen (95%BI: -1,22 tot 0,82).
5. FEV1
Daniels (2010) heeft de longfunctie, gemeten met FEV1, aan het begin van de studie, na tien dagen en na 30 dagen beoordeeld. Ten opzichte van de start van de studie was de FEV1 met 0,16 L(SD 0,26) bij gebruik van antibiotica toegenomen vergeleken met 0,11 L (SD 0,26) bij gebruik van een placebo (gemiddeld verschil van 0,05 L 95%BI: -0,02 tot 0,12). Een vergelijkbaar resultaat was na 30 dagen waargenomen. Bij gebruik van antibiotica was de toename in FEV1 0.15 L (SD 0,33) vergeleken met een toename van 0,08 (SD 0,25) (gemiddeld verschil van 0,07 L 95%BI: -0,03 tot 0,13).
Alonso Martinez (1992) heeft geen data over longfunctie gerapporteerd.
6. Bijwerkingen
Daniels (2010) heeft het aantal patiënten met bijwerkingen geassocieerd met het gebruik van antibiotica gerapporteerd alsmede ernstige bijwerkingen. Het is onduidelijk of deze groepen patiënten overlappen of dat het gaat om verschillende patiënten.
Vier (3%) patiënten die antibiotica kregen, hadden een bijwerking geassocieerd met het gebruik van antibiotica en vijf patiënten (4%) die een placebo kregen. Het ging hierbij om maagzuur, diarree of misselijkheid. Omdat het niet bekend is hoeveel patiënten maagzuurklachten hadden en omdat het aantal bijwerkingen laag is, is het niet mogelijk om een conclusie te formuleren over het risico op bijwerkingen bij gebruik van antibiotica.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat falen van behandeling is met twee niveaus verlaagd gezien indirectheid (verschillende definities falen van behandeling) en imprecisie (breed betrouwbaarheidsinterval).
De bewijskracht voor de uitkomstmaat mortaliteit en opnameduur zijn met twee niveaus verlaagd gezien alleen data werd gerapporteerd in Daniels (2010) en Alonso Martinez (1992) respectievelijk en brede betrouwbaarheidsintervallen bij de effectschattingen.
De bewijskracht voor de uitkomstmaat longfunctie, gemeten met FEV1, is met één niveau verlaagd gezien imprecisie (breed betrouwbaarheidsinterval).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling(en):
1. Wat is de effectiviteit van antibiotica bij patiënten die zijn opgenomen in het ziekenhuis na een COPD-longaanval?
P (welke patiëntcategorie) patiënten die zijn opgenomen in het ziekenhuis na een COPD-longaanval;
I (welke interventie) antibiotica/antibiotica met prednison/prednisolon(e);
C (welke comparison) prednison/prednisolon(e); placebo;
O (welke uitkomstmaten)
1) falen van behandeling, gedefinieerd als noodzaak tot intensiveren farmacologische behandeling, noodzaak tot ziekenhuisopname of terugkeer op spoedeisende hulp; opnameduur;
2) terugval, gedefinieerd als behandeling of ziekenhuisopname voor een COPD-longaanval na voltooiing van de studie-behandeling;
3) mortaliteit;
4) opnameduur;
5) FEV1;
6) bijwerkingen.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit een voor de besluitvorming kritieke uitkomstmaat en het falen van de behandeling een voor de besluitvorming belangrijke uitkomstmaat.
De werkgroep definieerde de uitkomstmaten als volgt:
- Het falen van behandeling wordt gedefinieerd als noodzaak tot intensiveren van farmacologische behandeling nog tijdens de fase van studiemedicatie. In de meeste studies voldeden opname op IC, of overlijden ook aan de definitie van falen van behandeling.
- Terugval wordt gedefinieerd als behandeling of ziekenhuisopname voor een COPD-longaanval na voltooiing van de fase met studiemedicatie, maar binnen 30 dagen. In een aantal studies voldeed ook presentatie op de spoedeisende hulp als terugval.
Zoeken en selecteren (Methode)
In de databases Medline (OVID) en Embase is met relevante zoektermen gezocht naar systematische reviews en gerandomiseerde trials. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 282 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische review (gezocht in tenminste twee databases met een objectieve en transparante zoekstrategie, data extractie en methodologische beoordeling) of gerandomiseerde trials van opgenomen patiënten met een COPD-longaanval onder behandeling van een antibioticum vergeleken met placebo. Op basis van titel en abstract werden in eerste instantie 40 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 39 studies geëxcludeerd (zie exclusietabel), en één studie definitief geselecteerd. Naast deze studie van Daniels (2010) werd ook een relevante Cochrane review gevonden (Vollenweider, 2012). Deze review includeerde naast de trial van Daniels (2010) ook een andere relevante trial van Alfonos Martinez (1992). Deze trial werd niet met de toegepaste zoekstrategie gevonden aangezien het artikel in het Spaans was geschreven en de zoekstrategie zich beperkte tot artikelen geschreven in het Engels of Nederlands. De resultaten van deze studie zijn, na vertaling, meegenomen in de samenvatting van literatuur.
Twee onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De evidencetabellen en beoordeling van individuele studiekwaliteit zijn opgenomen onder het tabblad Onderbouwing.
Referenties
- Alonso Martínez JL, Rubio Obanos MT, Sampériz Legarre AL, et al. Antibiotic treatment for acute episodes of chronic obstructive pulmonary disease. An Med Interna. 1992;9(8):377-80.
- Daniels JM, Snijders D, de Graaff CS, et al. Antibiotics in addition to systemic corticosteroids for acute exacerbations of chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2010;181(2):150-7.
- Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global Strategy for Diagnosis, Management, and Prevention of COPD 2016.
- http://www.wur.nl/upload_mm/0/b/c/433ca2d5-c97f-4aa1-ad34-a45ad522df95_92416_008804_NethmapMaran2016+TG2.pdf.
- NETH Map 2016:
- The Dutch Working Party on Antibiotic Policy (SWAB), Dutch Guidelines on the Management of Community-Acquired Pneumonia in Adults. 2011.
- Van der Eerden MM, Vlaspolder F, de Graaff CS, et al. Comparison between pathogen directed antibiotic treatment and empirical broad spectrum antibiotic treatment in patients with community acquired pneumonia: a prospective randomised study. Thorax. 2005;60:672678.
- Vollenweider DJ, Jarrett H, Steurer-Stey CA, et al. Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2012;12:CD010257.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question:
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Daniels, 2010 |
Type of study: Randomized, placebo-controlled trial
Setting: Two general hospitals
Country: The Netherlands
Source of funding: Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 128 (n=107 patients) Control: 137 (n=116 patients)
Important prognostic factors2: Age ± SD: I: 71 (10) C: 72 (9)
Sex: I: 57% M C: 62% M
Current smokers: I: 30% M C: 35% M
Groups comparable at baseline? Yes
|
7-day course of doxycycline
Concomitant treatment: Intravenously administered prednisolone (starting with 60 mg/d, tapering by 10 mg per 2 d to 40 mg/d followed by 30 mg of oral prednisolone on day 7, tapering by 5 mg per 2 d to 0 mg or the maintenance dose before admission), nebulized bronchodilator therapy four to six times daily and physiotherapy.
|
7-day course of placebo
Concomitant treatment: Intravenously administered prednisolone (starting with 60 mg/d, tapering by 10 mg per 2 d to 40 mg/d followed by 30 mg of oral prednisolone on day 7, tapering by 5 mg per 2 d to 0 mg or the maintenance dose before admission), nebulized bronchodilator therapy four to six times daily and physiotherapy.
|
Length of follow-up: 30 days
Loss-to-follow-up: Intervention: N=5 (4%) Reason: Did not meet eligibility criteria
Control: N=2 (1%) Reasons: 1 did not meet eligibility criteria, 1 withdrew consent after first dose
Incomplete outcome data: Intervention: N=17 (13%) Reasons: 2 withdrew consent, 8 had lack of efficacy, 7 had adverse event
Control: N=27 (20%) Reasons: 2 withdrew consent; 23 had lack of efficacy, 2 had adverse event
|
1. Treatment failure Defined as absence of resolution of symptoms and signs, worsening of symptoms and signs, occurrence of new symptoms and signs associated with the primary or a new infection or death.
I: 50 (39%) C: 65 (47%) RR: 0.82 (95%CI: 0.62-1.09)
2. Relapse Not reported
3. Mortality
I: 7 (7%) C: 3 (3%) RR: 2.53 (95%CI: 0.67-9.53)
4. Length of stay Not reported
5. Lung function Measured as FEV1 in L, mean (SD) and mean difference (95%CI)
Baseline I: 0.95 (0.45) C: 1.01 (0.44) Day 10 I: 0.16 (0.26) C; 0.11 (0.26) MD 0.05 (-0.02 to 0.12) Day 30 I: 0.15 (0.33) C: 0.08 (0.25) MD 0.07 (-0.03 to 0.13)
6. Adverse events
Related to the study medication* I: 4 (3%) C: 5 (4%) Adverse reactions in both groups were heartburn, diarrhea, and nausea.
Serious adverse events* I: 11 (9%) C: 7 (5%) Serious adverse events occurred in 11 patients (9%) from the doxycycline group (11 events, including 7 deaths) and 7 patients (5%) from the placebo group (7 events, including 3 deaths). Serious adverse events in the doxycycline group included pneumonia, urinary tract infection, myocardial infarction, and hypoglycemia. One patient died of gram-negative sepsis, four patients died of respiratory failure, and two patients died of acute heart failure. Serious adverse events in the placebo group included pneumonia and stomach perforation. One patient died of pneumonia and two died of respiratory failure. |
*Unclear whether this concerns different patients. |
|
Alonso Martinez, 1992 |
Type of study: Randomized, placebo-controlled trial
Setting: Emergency department
Country: Not stated
Source of funding: Not stated |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 90 patients I1: 29 I2: 32 C: 29
Important prognostic factors2: Age ± SD: 68
Sex: 84% M
Groups comparable at baseline? Not possinble |
1) Trimethoprim-sulphamethoxazole 1.9 g/day 2) Amoxicillin/clavulanic acid 1.9 g/day for 8 days |
Placebo for 8 days |
Length of follow-up: mean 7.2 days
Loss-to-follow-up: Not stated
Incomplete outcome data: Not stated
|
1. Treatment failure Defined as the use of additional antibiotics
I: 4 (7%) C: 6 (21%) RR: 0.32 (95%CI: 0.62-1.09)
2. Relapse Not reported
3. Mortality Not reported
4. Length of stay Mean in days (SD), mean difference (95%CI)
I: 7.9 (2.1) C: 8.1 (2.4) MD -0.20 (-1.22 to 0.82)
5. Lung function Not reported
6. Adverse events Not reported
|
All patients were treated with theophylline, inhaled bronchodilators and oxygen. If the numerical score was high or FEV1 < 40% they received 6-methylprednisolone 0.75mg/kg/day. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for intervention studies (randomized controlled trials)
Research question:
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Daniels, 2010 |
The allocation sequence was computer generated and kept in a safe at the hospital pharmacy through the course of the study. The study medication was delivered in pre-numbered containers. Doxycycline and placebo were prepared in identical capsules at a daily dose of 200mg. |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Alfonso Martinez, 1992 |
… |
Unlikely |
Unlikely |
Unlikely |
Unclear |
… |
… |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-01-2017
Laatst geautoriseerd : 13-04-2017
Geplande herbeoordeling :
De richtlijnwerkgroep heeft als doel de richtlijn periodiek (digitaal) van updates te voorzien.
De NVALT en LAN zijn als houder van deze richtlijn de eerstverantwoordelijken voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijken over relevante ontwikkelingen binnen hun vakgebied.
De KNMP heeft als lid van de LAN afgezien van autorisatie om inhoudelijke en procesmatige redenen. Het LAN bestuur, inclusief de overige leden van de LAN, hebben de richtlijn geautoriseerd. KNMP heeft bijgedragen als reviewer.
Algemene gegevens
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
In samenwerking met:
Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (NVALT)
Long Alliantie Nederland (LAN)
Nederlandse Vereniging voor Intensive Care (NVIC)
Nederlandse Vereniging van Diëtisten (NVD)
Nederlands Instituut van Psychologen (NIP)
Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
Verpleegkundigen & Verzorgenden Nederland (V&VN)
Longfonds
De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel van de richtlijn
In deze richtlijn worden aanbevelingen gedaan over de indicatiestelling van opname, het diagnostisch traject, de medicamenteuze en niet medicamenteuze behandeling tijdens ziekenhuisopname na COPD-longaanval, inclusief criteria voor monitoring en ontslag. Hiermee wordt een bijdrage geleverd aan een meer eenduidige, doelgerichte behandeling van patiënten met een COPD-longaanval in het ziekenhuis.
Beoogde gebruikers van de richtlijn
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met COPD en een longaanval die klinisch moeten worden behandeld. De gebruikers van de richtlijn (en het zorgpad) betreffen dan ook naast de longartsen veel andere medische beroepsgroepen zoals intensivisten, specialisten ouderengeneeskunde, huisartsen, longfunctieanalisten, verpleegkundigen (waaronder verpleegkundig specialisten en longverpleegkundigen), ziekenhuisapothekers, psychologen, fysiotherapeuten, diëtisten en ergotherapeuten.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten gedurende een ziekenhuisopname na een COPD-longaanval (zie hieronder). De werkgroepleden zijn door hun wetenschappelijke verenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- dr. F.J.J. van den Elshout (voorzitter), longarts, NVALT
- W.J.M. van Litsenburg (vicevoorzitter), verpleegkundig specialist, LAN/V&VN
- prof. Dr. H.A.M. Kerstjens, longarts, NVALT
- drs. P. L. Salomé, huisarts, COPD & Astma Huisartsen Advies Groep NHG
- drs. M.L.J. Scheer, longarts-intensivist, NVIC
- drs. R. van Snippenburg, longarts, NVALT
- dr. M. A. Spruit, fysiotherapeut, KNGF
- M.P.G. Stegers MSc, diëtist, NVD
- P.E.M. Fikkers-Mol MANP, verpleegkundig specialist, V&VN
- dr. J.N. de Voogd, psycholoog, NIP
- dr. S. Holverda, Longfonds (voorheen Astma Fonds)
Met ondersteuning van:
- P.H. Broos MSc, senior adviseur, Kennisinstituut van Medisch Specialisten
- dr. B.H. Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
Met dank aan:
- drs. L. Sekhuis, LAN
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiele belangen |
Persoonslijke relaties |
Reputatiemanagement |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
Getekend |
|
De Voogd |
gezondheidszorg psycholoog CvR UMCG |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
19-nov-15 |
|
Fikkers-Mol |
verpleegkundig specialist ziekenhuis Rijnstaete. |
alg. bestuurslid V&VN Longverpleegkundigen. Hier houd ik me, naast de reguliere bestuurstaken, vooral ook bezig met de scholingen. Hievoor ontvang ik vacatiegeld. |
geen |
geen |
geen |
geen |
geen |
geen |
25-sep-14 |
|
Kerstjens |
hoogleeraar en afdelingshoofd, afd. Longziekten en Tuberculose, Universitair Medisch Centrum Groningen |
tot 29-9-2014 secretaris bestuur Long Alliantie Nederland (onbetaald).Voorzitter Nordelijke CARA Stichting (onbetaald) |
geen PERSOONLIJK fin. Belang; betaling naar UMCG; over afgelopen 5 jaar ad hoc lid adviescommissie /adviseur/spreker voor verschillende farmaceutische bedrijven (Almiral, Astra Zeneca, Boehringer, Chiesi, GlaxoSmithKline, Novartis, Pfizer, Takeda) |
geen PERSOONLIJK fin. Belang; betaling naar UMCG; over afgelopen 5 jaar ad hoc lid adviescommissie /adviseur/spreker voor verschillende farmaceutische bedrijven (Almiral, Astra Zeneca, Boehringer, Chiesi, GlaxoSmithKline, Novartis, Pfizer, Takeda) |
|
over de afgelopen 5 jaar deelname aan onderzoek gefinancierd door overheid, astmafonds/longfonds. AstraZeneca, Boehringer, GlaxoSmithKline, Novartis, Pfizer, Takeda |
geen |
geen |
19-sep-14 |
|
Salomé |
huisarts |
kernlid CAHAG |
geen |
geen |
geen |
geen |
geen |
geen |
2-okt-14 |
|
Scheer |
longarts -intensivist. Volledig werkzaam op de IC in de functie van intensivist |
EMS B instructeur (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
ja 8 jan 2015 |
|
Spruit |
wetenschappelijk adviseur CIRO + te Horn (NL) |
Gastprofessor in Hassels University te Hasselt (B) - betaald |
geen |
geen |
geen |
geen |
werkzaam bij het CIRO+, alwaar longrevalidatie wordt aangeboden als zorgproduct. Verwijzing naar longrevalidatie kan een mogelijk resultaat zijn van de commisie. |
geen |
ja 18 sept 2014 |
|
Stegers |
dietist in CWZ |
geen |
geen |
geen |
ik ben lid van de NVD, maar participerend lid. Vanuit de NVD ook gevraagd voor deze richtlijn. |
2011-2013 meegedaan aan onderzoek Zicht op gewicht via Medizorg B.V. Gegevens zijn verzameld, resultaten moet nog gepresenteerd worden. |
geen |
geen |
25-sep-14 |
|
Van den Elshout |
longarts Rijnstate Ziekenhuis Arnhem (fulltime) voorzitter richtijn commissie |
lid centraal tuchtcollege Den Haag; vacatiegelden komen ten goede aan de maatschap longartsen |
geen |
geen |
geen |
educational Grant GSK voor promovendus |
geen |
geen |
6-okt-14 |
|
Van Litsenburg |
verpleegkundig specialist longgeneeskunde |
Lid kernteam PICASSO |
geen |
geen |
geen |
geen |
geen |
geen |
ja, 3 dec 2014 |
|
Van Snippenburg |
longarts |
vz MCC Diakonessenhuis Utrecht (onbetaald) |
geen |
geen |
lid werkgroep COPD vd NVALT. Lid werkgroep Transmuraal Zorgpad Longaanval LAN. |
in afrondende fase van Liaison studie (in opdracht van Chisi) astma survey studie |
samen met patient een DVD geproduceerd over Bewegen bij COPD voor patieten. Sponsoring door GSK, eenmalig en Swieringa Stichting eenmalig. Auteursrechten van deze DVD liggen bij van der Colk BV. DVD is gratis verstrekt aan zorgverleners tbv patiënten en rechtstreeks aan patiënten. Zolang de voorraad strekt. |
geen |
20-okt-14 |
|
Vercoulen |
Klinisch Psycholoog/sectieleider Medische Psychologie Volwassenen en Ouderen, Radboudumc |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
ja 23 feb 2015 |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door middel van vertegenwoordiging van het Longfonds in de werkgroep. Daarnaast heeft de Longfonds de conceptrichtlijn beoordeeld tijdens de commentaarfase en suggesties voor verbetering van de richtlijn gegeven.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn wordt opgenomen in de richtlijnendatabase (www.richtlijnendatabase.nl) waarmee hij toegankelijk is voor alle relevante beroepsgroepen en patiënten. Daarnaast wordt er een samenvatting van de richtlijn gepubliceerd in tijdschriften van de deelnemende wetenschappelijke verenigingen. Ook is de richtlijn te downloaden vanaf de website van betrokken wetenschappelijke verenigingen en de Long Alliantie Nederland.
Werkwijze
AGREE II
Deze richtlijn is opgesteld conform de eisen in het rapport ‘Richtlijnen 2.0’ van de adviescommissie Richtlijnen van de Raad kwaliteit van de Orde van Medisch Specialisten. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org), dat een internationaal breed geaccepteerd instrument is voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
In de eerste fase werden de knelpunten geïnventariseerd. Tevens is gebruikt gemaakt van de knelpuntenanalyse bij de ontwikkeling van het landelijk zorgpad COPD-longaanval met ziekenhuisopname dat parallel aan deze richtlijn is ontwikkeld.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn vervolgens verder uitgewerkt door de leden van de werkgroep en tijdens de werkgroepvergadering vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews in Medline (OVID) en Cochrane Library. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag. De gedetailleerde zoekstrategieën zijn vermeld per module.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de kolom ‘Beoordeling kwaliteit studie’ van een evidence-tabel.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://gdt.guidelinedevelopment.org/app/handbook/handbook.html).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (Van Everdingen, 2004).
Formuleren van de conclusies
Bij interventievragen verwijst de conclusie niet naar een of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op voor elke interventie. Bij het opmaken van de balans werden door de werkgroep de gunstige en ongunstige effecten voor de patiënt afgewogen.
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie(s), waarbij het niveau van het meest relevante bewijs is weergegeven. Omwille van de homogeniteit is het niveau van bewijs voor alle conclusies weergegeven als hoog/matig/laag/zeer laag, waarbij EBRO niveau 1 is vertaald naar hoog, 2 naar matig, 3 naar laag en 4 naar zeer laag.
Wanneer er voor een uitgangsvraag geen systematisch literatuuronderzoek werd verricht, is de literatuur niet beoordeeld op kwaliteit en is de kracht van het bewijs niet bepaald.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover niet wetenschappelijk onderzocht, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. Bij het formuleren en graderen van de aanbeveling worden minimaal de volgende vier factoren in ogenschouw genomen: algehele kwaliteit van het wetenschappelijke bewijs; balans tussen voor- en nadelen van de interventie; waarden en voorkeuren van professional en patiënten; en beschikbare middelen.
Indicatorontwikkeling
De werkgroep heeft besloten geen nieuwe indicatoren bij deze richtlijn te ontwikkelen, maar gebruik te maken van de reeds bestaande indicatoren op het gebied van COPD.
Kennislacunes
Tijdens de ontwikkeling van de richtlijn ‘Diagnostiek en Behandeling van een COPD-longaanval in het Ziekenhuis’ is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de uitgangsvragen. Een deel (of een onderdeel) van de uitgangsvragen is met het resultaat van deze zoekacties te beantwoorden, een groot deel echter niet. Door gebruik te maken van de evidence-based methodiek (EBRO) is duidelijk geworden dat op het terrein van longaanvallen COPD nog lacunes in de beschikbare kennis bestaan. Een inventarisatie hiervan is opgenomen in de bijlage bij de richtlijn.
Literatuur
Atkins D, Best D, Briss PA, et al. Grading quality of evidence and strength of recommendations. BMJ. 2004;328(7454):1490.
Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum. 2004.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.

